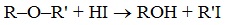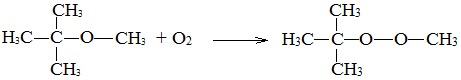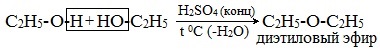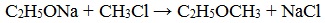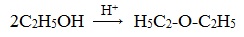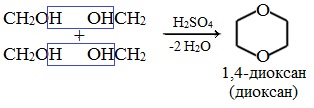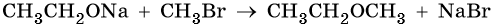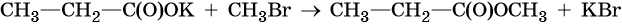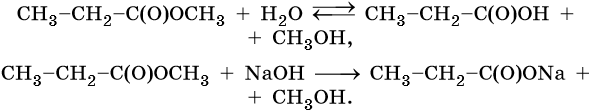Эфир в химии что это
Эфир (химия)
Эфи́ры (др.-греч. αἰθήρ — горный воздух) — название нескольких химических соединений и их видов. Данная многозначность сложилась в процессе развития химической номенклатуры (изначально существовал один общий класс веществ).
Полезное
Смотреть что такое «Эфир (химия)» в других словарях:
Эфир — (др. греч. αἰθήρ верхний слой воздуха) многозначный термин. Содержание 1 Мифология и философия 2 Физика … Википедия
ХИМИЯ ОРГАНИЧЕСКАЯ. КЛАССЫ СОЕДИНЕНИЙ — Органические соединения (углеводороды и их производные) можно разделить на два типа: ациклические (или алифатические, т.е. с открытой углеродной цепью) и циклические; последние в свою очередь подразделяются на алициклические, в молекулах которых… … Энциклопедия Кольера
Химия природных соединений — (ХПС) раздел органической химии, изучающий химические соединения, входящие в состав живых организмов, природные пути их превращений и методы искусственного получения. Как наука, химия природных соединений возникла одновременно с… … Википедия
ХИМИЯ ОРГАНИЧЕСКАЯ. МОЛЕКУЛЯРНАЯ СТРУКТУРА — А. ХИМИЧЕСКИЕ СВЯЗИ УГЛЕРОДА Химическая природа углерода, промежуточная между металлами и типичными неметаллами, позволяет ему образовывать ковалентные связи с большим числом элементов, чаще всего с водородом, кислородом, азотом, галогенами,… … Энциклопедия Кольера
ХИМИЯ ОРГАНИЧЕСКАЯ. НОМЕНКЛАТУРА СОЕДИНЕНИЙ — Для наименования органических соединений используется несколько систем, но ни одна из них не подходит для всех соединений. Сохранились многие тривиальные названия, которые либо применялись еще в начальный период органической химии и отражают… … Энциклопедия Кольера
Диэтиловый эфир — Общие … Википедия
Этиловый эфир — Диэтиловый эфир Общие Систематическое наименование 1,1 Окси бис этан Химическая формула C4H10O Молярная масса 74,12 г/моль … Википедия
ОРГАНИЧЕСНАЯ ХИМИЯ — первоначально составляла часть химии вообще и не имела особого названия; позже под О. х. стали разуметь химию веществ, встречающихся только в животном и растительном организме. Берцелиус (Berzelius) определил в 1827 г. О. х. как химию… … Большая медицинская энциклопедия
Метил-трет-бутиловый эфир — Метил трет бутиловый эфир … Википедия
Органическая химия — раздел химии (См. Химия), естественнонаучная дисциплина, предметом изучения которой являются соединения углерода с др. элементами, называемые органическими соединениями, а также законы превращения этих веществ. Углерод образует соединения … Большая советская энциклопедия
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
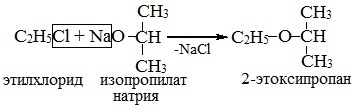
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
| Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат. |
CH3-COONa + CH3-Cl = CH3-COOH + NaCl
Эфиры (общие сведения, физические, химические и фармакологические свойства, применение в медицине и фармации)
Общие сведения
Физические, химические и фармакологические свойства
Таблица. Свойства эфиров
| Формула | Название | Ткип, оС | Тпл, оС |
| СН3ОСН3 | Диметиловый эфир (метоксиметан) | -23.7 | -138,5 |
| СН3ОС2Н5 | Метилетиловый эфир (метоксиетан) | 8 | — |
| С2Н5ОС2Н5 | Диэтиловый эфир (этоксиэтан) | 34,6 | -116,3 |
| С2Н5ОСН = СН2 | метилвиниловый эфир (этоксиэтилен) | 36 | — |
| С3Н7ОС3Н7 | Дипропиловый эфир (пропоксипропан) | 91 | -122 |
| С6Н5ОСН3 | Метоксибензол (анизол) | 155 | -37 |
| С6Н5ОС2Н5 | Этоксибензол (фенетол) | 172 | -33 |
| С6Н5ОС6Н5 | Дифениловый эфир (феноксибензол) | 259 | 27,5 |
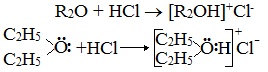
Эфиры достаточно инертными веществами. Разведенные минеральные кислоты, водные растворы щелочей и щелочные металлы с ними не взаимодействуют. Реакционная способность виниловых и арилових эфиров обусловлена углеводородными радикалами. Через неразделенные пары электронов на атоме кислорода эфиры проявляют слабые основные свойства и с концентрированными минеральными кислотами образуют неустойчивые соли оксония.
СН3ОСН3 + НЕТ → СН3ОН + СН3И.
Диариловые эфиры устойчивы к действию концентрированной йодоводистой кислоты. Расщепление метил и этилалкиловых эфиров используют для количественного определения метокси- и этоксигруп (метод Цейзеля). Концентрированная H2SO4 превращает эфиры сложные субстанции серной кислоты, а виниловые эфиры в кислой среде гидролизуются до альдегидов или кетонов и спиртов:
Виниловые эфиры способны полимеризоваться, что используется в синтезе ВМС. При действии алкилнатрия или алкиллития на эфиры происходит β-элиминирования с образованием алкенов:
CH3CH2OCH2CH3 + RNa 1arrow.eps CH2 = CH2 + C2H5ONa + RH.
C6H5ONa + (CH3) SO4 C6H5OCH3 + CH3OSO3Na.
эфиры также образуются по реакции присоединения спиртов или фенолов к олефинов. При нагревании спиртов с ацетиленом получают алкилвиниловые эфиры
Взаимодействие ацетилена с диазометаном приводит к образованию алкил- и арилметиловых эфиров.
Применение в медицине и фармации
Литература
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Эфир в химии что это
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R», где R’ и R» — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
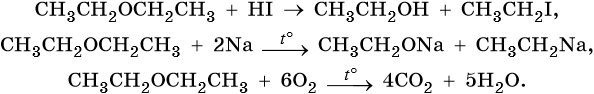
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО – (в одной молекуле спирта) на группу RO – (от другой молекулы):
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl – ) на алкоксигруппу (CH3O – ):
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид) 
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Простые и сложные эфиры
Простые эфиры образуются при межмолекулярной дегидратации спиртов, а также при взаимодействии алкоголятов с галоидными алкилами, например:
Простые эфиры химически инертны. Их характерные реакции на примере диэтилового эфира:
Пары диэтилового эфира пожаро- и взрывоопасны.
Сложные эфиры образуются в результате реакции этерификации (урок 25). При этом следует отметить, что при одной и той же кислоте скорость этерификации первичных спиртов в два раза выше, чем у вторичных и во много раз превосходит третичные.
Кроме того, сложные эфиры можно получить в результате взаимодействия солей карбоновых кислот с галоидными алкилами:
Для сложных эфиров характерны изомерия углеводородных радикалов кислот и спиртов, составляющих сложный эфир, а также межклассовая изомерия с карбоновыми кислотами. Ниже приведены реакции, иллюстрирующие характерные химические свойства сложных эфиров.
1. Кислый или щелочной гидролиз:
2. Реакция переэтерификации (идет в том случае, если брать избыток спирта и отгонять образующийся более легкокипящий спирт):