Эхогенный фокус в левом желудочке сердца плода что это такое
Эхогенный фокус в левом желудочке сердца плода что это такое
а) Лучевая диагностика:
• Небольшая яркая точка ( > справа > с обеих сторон
о Существует риск диагностических ошибок
• Гиперэхогенный внутрисердечный фокус (ГВФ) чаще всего является изолированной находкой у пациентов группы низкого риска:
о Порок развития и нарушение функции сердца отсутствуют
о Изолированный ГВФ слабо связан с Т21:
— Отношение правдоподобия: 1,4-1,8
— Обнаруживают другие маркеры Т21
о Наличие сопутствующих выраженных аномалий связано с Т13
о Наличие множественных ГВФ с большей вероятностью может быть связано с анеуплоидией
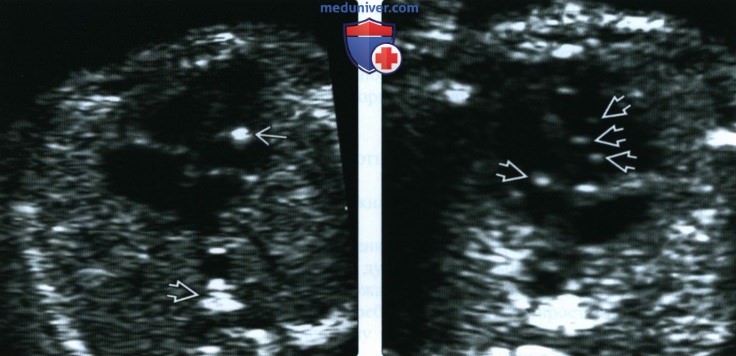
(Справа) Другой случай. В сердце плода с обеих сторон видны многочисленные ГВФ. Многочисленные ГВФ по сравнению с изолированным единственным ГВФ связаны с более высоким риском анеуплоидии. В большинстве случаев ГВФ выявляют у плодов с нормальным кариотипом, относящихся к группе низкого риска. 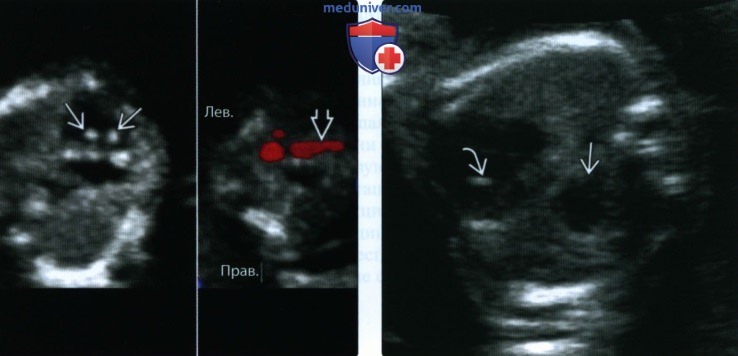
(Справа) УЗИ грудной клетки плода с диафрагмальной грыжей и Т13, поперечная плоскость. Визуализируются ГВФ, а также отклонение оси сердца, обусловленное выпадением желудка в грудную клетку. ГВФ, сочетающийся с той или иной аномалией развития, позволяет заподозрить анеуплоидию.
б) Дифференциальная диагностика гиперэхогенного внутрисердечного фокуса:
• Рабдомиома:
о Гомогенное гиперэхогенное образование в миокарде
• АВСД:
о Остаточная ткань клапана может напоминать ГВФ
в) Патологоанатомические особенности:
• В основе предположительно лежит микрокальцификация в толще сосочковой мышцы
г) Клинические особенности:
• ГВФ присутствует у 4-7% плодов с нормальным кариотипом
• Связь с анеуплоидией:
о ГВФ присутствует у 15-30% плодов с Т21
о ГВФ присутствует у 30—40% плодов с Т13
• Этническая вариабельность противоречива:
о Среди уроженцев Азии ГВФ присутствует у 20% плодов
о Более высокая частота диагностики, вероятно, связана с более низким индексом массы тела женщин в среднем, чем с этнической предрасположенностью
д) Особенности диагностики:
• Изолированный ГВФ у пациента группы низкого риска считается вариантом нормы
• ГВФ диагностируют только в том случае, если эхогенность очага не уступает эхогенности костной ткани
• Наблюдение по поводу ГВФ у пациентов группы низкого риска не требуется
Редактор: Искандер Милевски. Дата обновления публикации: 13.10.2021
В левом желудочке плода гиперэхогенный фокус: что это, какая причина и как действовать
Нередко при проведении беременным ультразвукового обследования у плода в сердце обнаруживают небольшое светлое пятнышко. Часто врачи называют его «мяч для гольфа», поскольку при наличии сердцебиения он напоминает прыгающий белый шарик. В заключении доктор описывает это как гиперэхогенный фокус в сердце плода. Несмотря на кажущийся угрожающий характер определения, данный термин не подразумевает какого-либо патологического состояния.
Подобное явление считается вариантом нормы и обнаруживается у четверти беременных. При отсутствии других патологических признаков не требуется никаких дополнительных обследований.
Что такое гиперэхогенность в сердце плода

Чаще всего это обнаруживается у женщин старше 35 лет на 18—22-й неделе беременности. Наиболее характерен феномен для представительниц азиатских стран. На европейском континенте подобное явление встречается намного реже (в 7—10 % случаев). Обычно уплотнение исчезает к концу третьего триместра, однако нередко остается вплоть до родов.
Чаще всего находят гиперэхогенное включение в левом желудочке сердца плода, тем не менее оно может визуализироваться и в других частях органа. Более опасным считается присутствие повышенной эхогенности в правых отделах.
Патологическим данное явление может считаться лишь в случаях, когда оно сопутствует другим признакам врожденных заболеваний. Также важно помнить, что это всего лишь диагностический признак, который не является самостоятельной патологией и не несет каких-либо негативных последствий в будущем.
Причины
Источником гиперэхогенного включения сердца плода может быть отложение солей кальция в сосочковых мышцах левого желудочка. В указанные сроки происходят значительная активация минерального обмена и интенсивное формирование костной системы. Со временем соль всасывается в кровь и уплотнение исчезает.
В некоторых случаях подобный симптом дает наличие добавочной хорды. Это соединительнотканная нить, которая проходит от клапанов сердца к папиллярным (сосочковым) мышцам. Чаще всего каждой мышце соответствует одна нить, однако в данном случае их образуется несколько.
При прохождении крови через хорды будут возникать завихрения, которые могут образовывать сердечные шумы, выслушиваемые при аускультации. Об этом следует помнить, потому что в дальнейшем из-за присутствия данного феномена педиатр может поставить неправильный диагноз. Несмотря на то что это явление рассматривается как аномалия сердца, такой вариант развития принимается за норму.
Обнаружение дополнительной хорды не требует дальнейшего исследования и лечения. Как правило, они срастаются еще до рождения или в первые годы жизни.
Раньше считалось, что ГЭФ ЛЖ является четким признаком синдрома Дауна или других хромосомных заболеваний. Но в последние годы появилось много научных работ, благодаря которым теперь известно, что это справедливо лишь при наличии дополнительных симптомов. Обнаружение только одного этого признака не может быть поводом для беспокойства, дальнейшие обследования не требуются.
Тактика действий
В большинстве случаев при обнаружении гиперэхогенного включения показано проведение дополнительного исследования. При этом могут назначить:
Достаточно редко применяют инвазивные диагностические процедуры:
В первую очередь, конечно же, следует исключить генетические причины гиперэхогенного включения. Для этого врач-диагност проводит поиск других малых маркеров хромосомных патологий. К ним относятся врожденные пороки сердца, утолщение шейной складки, нарушения развития желудочно-кишечного тракта, костной системы. Обычно они выявляются в ходе ультразвукового исследования. При их обнаружении необходима консультация у специалиста-генетика.
Если никаких дополнительных признаков не обнаружено, плод можно считать вполне здоровым. Тем не менее в первые месяцы после рождения рекомендуется провести контрольную эхокардиографию. Данная процедура позволит окончательно убедиться в отсутствии каких-либо патологических изменений.
Выводы
Таким образом, обнаруживаемое при УЗИ гиперэхогенное включение не является самостоятельным диагнозом. По системе оценки маркеров хромосомных аномалий ему начисляют лишь один балл, что не может быть поводом для беспокойства.
Чаще всего ГЭФ возникает вследствие физиологических процессов или доброкачественных аномалий развития сердца (появление ложной хорды). При этом, если не обнаружено других анатомических или функциональных отклонений, не требуется никаких дальнейших обследований и лечения. Достаточно будет контроля при проведении планового УЗИ в третьем триместре беременности.
Для подготовки материала использовались следующие источники информации.
Если при ультразвуковом исследовании найден гиперэхогенный фокус в желудочке сердца
Что такое гиперэхогенный фокус в сердце у плода?
Гиперэхогенный фокус – это термин, говорящий о повышенной эхогенности (яркости) небольшого участка сердечной мышцы на ультразвуковом изображении. Выявление гиперэхогенного фокуса в сердце НЕ является пороком развития сердца, а просто отражает характер его ультразвукового изображения. Гиперэхогенный фокус возникает в месте повышенного отложения солей кальция на одной из мышц сердца, что не мешает нормальной работе сердца плода и не требует никакого лечения.
Почему у плода может выявляться гиперэхогенный фокус в сердце?
Возможные причины возникновения гиперэхогенного фокуса в сердце:
Что делать при выявлении гиперэхогенного фокуса в сердце плода?
При возникновении гиперэхогенного фокуса:
*Существует ряд пороков развития, которые могут быть выявлены только в третьем триместре беременности. Естественно, большинство пороков развития (пороки сердца, расщелины губы и неба, позвоночные грыжи, аномалии количества пальцев на кистях и стопах и многие другие) исключаются или диагностируются во втором триместре беременности.
В третьем триместре могут проявиться заболевания, связанные с неправильной работой некоторых органов и систем, которые изначально сформировались нормально.
В силу каких-то причин в организме человека на любом этапе жизни могут возникать определенные изменения. Иногда они возникают в пожилом или среднем возрасте, а иногда – уже во внутриутробном периоде. Именно эти особенности мы изучаем на скрининге в третьем триместре беременности: ищем признаки кишечной непроходимости, оцениваем работу почек, т.к. иногда у плода формируется нарушение оттока мочи из почек, приводящее к возникновению гидронефроза (повышенного скопления мочи в чашечно-лоханочной системе почек), исключаем кисты органов брюшной полости и яичников, убеждаемся в отсутствии новообразований (опухолей) плода.
Очень важно оценить развитие головного мозга, т.к. этот орган все еще продолжает формироваться, и иногда мы видим повышенное количество жидкости в желудочковой системе мозга (вентрикуломегалия и в тяжелых случаях гидроцефалия), которое мешает нормальному развитию ткани мозга. Иногда у плода формируются опухоли мозга или внутричерепные кровоизлияния, которые так же будут сдавливать и повреждать соседние ткани мозга.
Некоторые пациенты спрашивают: зачем выявлять пороки развития в 32-34 недели беременности, если все равно никаких действий до родов не будет сделано, ребенок уже жизнеспособен и вопрос о прерывании беременности уже не обсуждается.
Действительно, на этих сроках беременности показания к прерыванию беременности возникают лишь в исключительных случаях. Однако, информация о наличии у ребенка определенных особенностей и заболеваний может оказать существенную помощь неонатологам, детским хирургам, неврологам и нейрохирургам, т.к. после рождения иногда бывает дорога каждая минута жизни.
Наличие известного диагноза позволяет всем специалистам быть готовым к рождению такого ребенка и к оказанию неотложной помощи своевременно и в полном объеме, что существенно увеличивает шансы на выздоровление малыша.
Приятный бонус к 3 скринингу в Центре Медицины плода: всем пациентам мы вручаем сертификат на первое бесплатное посещение неонатолога. Воспользоваться подарком можно в течение полугода с момента рождения малыша.
Мы надеемся, что эта информация помогла Вам узнать, какое значение имеет скрининговое ультразвуковое исследование в третьем триместре беременности. Коллектив Центра медицины плода желает Вам здоровья, легкого течения беременности и рождения здорового малыша!
УЗИ при беременности в Центре медицины плода – высочайшая точность исследований и экспертная диагностика здоровья плода!
Все ультразвуковые обследования в центре проводятся по международным стандартам FMF (Fetal Medicine Foundation) и ISUOG (Международного общества ультразвука в акушерстве и гинекологии).
Врачи ультразвуковой диагностики имеют международные сертификаты Fetal Medicine Foundation (Фонд медицины плода, Великобритания), которые подтверждаются ежегодно.
Мы беремя за самые сложные случаи и, при необходимости, возможно проведение консультации со специалистами Госпиталя Королевского Колледжа, King’s College Hospital (Лондон, Великобритания).
Возможности этих приборов позволяют говорить о новом уровне информативности.
Записаться на прием
Записаться на прием и получить экспертное мнение наших специалистов ультразвуковой диагностики вы можете по телефону единого контакт центра +7 (812) 458-00-00
Маркеры патологического течения перинатального периода у детей с гиперэхогенным внутрисердечным фокусом
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Цель исследования: выявить особенности течения перинатального периода у детей с антенатально диагностируемым гиперэхогенным внутрисердечным фокусом (ГВФ).
Материал и методы: группы исследования, которые формировали по методу «случай — контроль», были сопоставимы по возрасту, акушерскому и соматическому анамнезу матерей. Критерием включения в первую группу было наличие гиперэхогенного образования в сердце плода, по данным ультразвукового пренатального скрининга, а также наблюдение и рождение ребенка в ГБУЗ ТО «Перинатальный центр» (Тюмень). Первую группу составили 214 беременных (плодов с ГВФ, впоследствии новорожденных), вторую группу — 107 беременных (плодов без ГВФ, впоследствии новорожденных). Проведен ретроспективный анализ течения антенатального и интранатального периодов развития новорожденных с ГВФ; изучены особенности течения раннего неонатального периода, данные гистологического исследования плацент (n=69), результаты аутопсий перинатальных потерь (n=12).
Результаты исследования: установлено, что ГВФ, впервые визуализируемые после 20-й нед. гестации, сохранялись после рождения значительно чаще (р 0,05). Между тем только у детей с ГВФ диагностированы врожденные пороки развития различных органов (7,94%) и генерализованная цитомегаловирусная инфекция (1,46%). Постгипоксическую кардиопатию как отражение синдрома дезадаптации со стороны сердечно-сосудистой системы в 3,2 раза чаще регистрировали у новорожденных с ГВФ (р=0,005).
Заключение: сочетание ГВФ (размером 2,67±0,9 мм) с локализацией в левом или правом желудочке сердца плода и других мягких ультразвуковых маркеров, наличие структурных изменений центральной нервной системы и/или системы кровообращения диктуют необходимость обследования беременной на внутриутробные инфекции, а также проведения допплерографии маточных и пуповинных артерий для минимизации риска развития перинатальных катастроф.
Ключевые слова: перинатальный период, гиперэхогенный внутрисердечный фокус, новорожденные, перинатальные потери, врожденная аномалия, постгипоксическая кардиопатия, ультразвуковой маркер.
Для цитирования: Малинина Е.И., Рычкова О.А., Чернышева Т.В. Маркеры патологического течения перинатального периода у детей с гиперэхогенным внутрисердечным фокусом. РМЖ. Мать и дитя. 2020;3(2):132-135. DOI: 0.32364/2618-8430-2020-3-2-132-135.
Markers of the pathological course of perinatal period in children with echogenic intracardiac focus
1 Tyumen State Medical University, Tyumen, Russian Federation
2 Tyumen Cardiology Research Center — branch of Tomsk National Research Medical Center
of the Russian Academy of Sciences, Tyumen, Russian Federation
Aim: to describe the course of perinatal period in children with echogenic intracardiac focus (EIF) diagnosed in the antenatal period.
Patients and Methods: in this case-control study, the groups were similar in age, obstetric history, and somatic status of mothers. Group 1 included 214 pregnant women whose fetus (newborn later) was diagnosed with EIF. Inclusion criteria were an echoic focus within the fetal heart (by prenatal ultrasound) as well as pregnancy follow-up and childbirth in the Perinatal Center of Tyumen city. Group 2 included 107 pregnant women whose fetus (newborn later) had no this sonographic sign. Retrospective analysis of the course of antenatal and intranatal periods of newborns with EIF was performed. The course of early neonatal period was described. Placental histology (n = 69) and autopsies of perinatal losses (n=12) were discussed.
Results: it was demonstrated that EIFs identified for the first time after 20 weeks of gestation persist after delivery much more common (p 0.05). Only newborns with EIF were diagnosed with different types of birth defects (7.94%) and generalized cytomegalovirus infection (1.46%). Hypoxic cardiopathy (that illustrates cardiovascular deadaptation) was 3.2 times more common in newborns with EIF (p=0.005).
Conclusion: combination of EIF (2.67±0.9 mm) localized in the left or right ventricle and other sonographic signs, central nervous system defects and/or cardiovascular abnormalities require screening for perinatal infections as well as uterine and umbilical artery Doppler to minimize the risk of perinatal events.
Keywords: perinatal period, echogenic intracardiac focus, newborns, perinatal losses, congenital anomaly, hypoxic cardiopathy, sonographic sign.
For citation: Malinina E.I., Rychkova O.A., Chernysheva T.V. Markers of the pathological course of perinatal period in children with echogenic intracardiac focus. Russian Journal of Woman and Child Health. 2020;3(2):132–135. DOI: 10.32364/2618-8430-2020-3-2-132-135.
Введение
Интерес к изучению перинатального периода появился в конце 1960-х гг., когда в рутинную практику врачей разных специальностей вошло ультразвуковое исследование (УЗИ) высокого разрешения, что способствовало выявлению не только грубых аномалий развития того или иного органа, но и малых структурных изменений [1, 2]. Это послужило толчком к совершенствованию методов профилактики, диагностики и терапии различных заболеваний матери, плода и новорожденного и восприятию системы «мать — плацента — плод» как единого организма [3].
В 1990-х гг. работы патоморфологов D.J. Roberts и D. Genest по изучению участков кальцификации папиллярных мышц, или гиперэхогенных внутрисердечных фокусов (ГВФ), у плодов с аномальным кариотипом стали основанием для того, чтобы рассматривать данную ультразвуковую находку как маркер хромосомных аномалий [4–6]. Эти образования при проведении УЗИ совершали колебательные движения подобно прыжкам мяча и были названы «гольфный мяч» [7, 8]. Гипотезы формирования ГВФ неоднократно менялись (от нормального варианта эмбрионального развития клапанно-хордального аппарата до предиктора внутриутробного инфицирования плода), однако до сих пор не существует единого мнения об этом ультразвуковом феномене [9–13].
Цель работы: выявить особенности течения перинатального периода у детей с антенатально диагностируемым ГВФ.
Материал и методы
Настоящее ретроспективное исследование проведено на базе ГБУЗ ТО «Перинатальный центр» (Тюмень). Критерием включения было наличие гиперэхогенного образования в сердце плода, по данным ультразвукового пренатального скрининга. Группы исследования формировали методом «случай — контроль», при этом статистически значимых межгрупповых различий по возрасту, акушерскому и соматическому анамнезу матерей не было. Первую группу составили 214 беременных (плодов c ГВФ, впоследствии новорожденных), вторую группу — 107 беременных (плодов без ГВФ, впоследствии новорожденных). Анализировали течение перинатального периода новорожденных с ГВФ с использованием медицинской документации (ф111/у и ф096/у), результатов инструментального обследования (электрокардиографии, нейросонографии, эхокардиографии (ЭхоКГ), УЗИ органов брюшной полости), а также патоморфологического исследования 69 плацент (34 из первой группы и 35 — из второй) и перинатальных потерь (n=12). Не все плаценты подвергались патоморфологическому исследованию, но для настоящего исследования с учетом сформированных групп были отобраны заключения с учетом сходного срока гестации и анамнеза.
Результаты и обсуждение
В ходе исследования установлено, что в 11–13 нед. гестации при пренатальном ультразвуковом скрининге диагностируется 6,08% ГВФ, в 20–22 нед. — 84,11%, в 32–34 нед. — 9,81%. Нужно отметить, что все ГВФ, визуализируемые при первом ультразвуковом скрининге, локализовались в левом желудочке и были одиночными, имея средний размер 1,2±0,1 мм. В то же время локализация гиперэхогенных образований, диагностируемых во второй половине беременности, была различной, а также отмечались множественные фокусы, размер которых превышал 2 мм. Динамическое наблюдение показало, что к моменту рождения сохраняются лишь 0,46% ГВФ, регистрируемых до 14-й нед., и 24,3% ГВФ, выявляемых впервые после 20-й нед. гестации.
Антенатальное УЗИ выявило, что 1/3 пациентов с ГВФ начиная с 20-й нед. гестации имеют ультразвуковые признаки изменений в плаценте: аномальное прикрепление, кистозные изменения, увеличение/уменьшение количества околоплодных вод, снижение маточно-плацентарного кровотока в целом.
Таким образом, ГВФ визуализируется при ультразвуковом скрининговом исследовании на любом сроке гестации, чаще (до 90,19%) с 9-й по 22-ю нед. беременности. Его обнаружение было сопряжено с нарушениями маточно-плацентарного кровотока (р=0,033) и другими малыми ультразвуковыми маркерами хромосомных аномалий в 24,76% случаев (р 1 Малинина Елена Игоревна — к.м.н., доцент кафедры детских болезней лечебного факультета с курсом иммунологии и аллергологии, ORCID iD 0000-0001-9987-4899;
1 Рычкова Ольга Александровна — д.м.н., доцент, заведующая кафедрой детских болезней лечебного факультета с курсом иммунологии и аллергологии, ORCID iD 0000-0002-2566-5370;
2 Чернышева Татьяна Викторовна — к.м.н., доцент, заведующая детским отделением, ORCID iD 0000-0003-0137-3282.
1 ФГБОУ ВО Тюменский ГМУ Минздрава России. 625024, Россия, г. Тюмень, ул. Одесская, д. 54.
2 Тюменский кардиологический научный центр — филиал Томского НИМЦ. 625026, Россия, г. Тюмень, ул. Мельникайте, д. 111.
Контактная информация: Малинина Елена Игоревна, e-mail: malininaele@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах. Конфликт интересов отсутствует. Статья поступила 31.07.2019.
1 Elena I. Malinina — MD, PhD, associate professor of the Department of Childhood Diseases the Course of Immunology & Allergy of Medical Faculty, ORCID iD 0000-0001-9987-4899;
1 Olga A. Rychkova — MD, PhD, Associate Professor, Head of the Department of Childhood Diseases the Course of Immunology & Allergy of Medical Faculty, ORCID iD 0000-0002-2566-5370;
2 Tat’yana V. Chernysheva — MD, PhD, Associate Professor, Head of Children Department, ORCID iD 0000-0003-0137-3282.
1 Tyumen State Medical University. 54, Odesskaya str., Tyumen, 625024, Russian Federation.
2 Tyumen Cardiology Research Center— branch of Tomsk National Research Medical Center of the Russian Academy of Sciences. 111, Melnikaite str., Tyumen, 625026, Russian
Federation.
Contact information: Elena I. Malinina, e-mail: malininaele@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 31.07.2019.
Только для зарегистрированных пользователей
Распространенные мягкие УЗИ-маркеры пороков развития плода
В главе, посвященной пренатальной диагностике, упоминалось, что часто при проведении УЗИ находят «мягкие» или «малые» признаки, которые могут ассоциироваться с врожденными пороками развития или же быть проявлением нормы. Их находят в 5% всех беременностей. Но часто такие находки вызывают стрессовую ситуацию у женщины, так как она не получает достаточно информации в отношении прогноза беременности или же информация ложная.
К распространенным мягким УЗИ-признакам относят увеличенную шейную складку и короткую носовую косточку в первом триместре, что было обсуждено в главе о пренатальном генетическом скрининге. Во втором триместре часто встречаются вентрикуломегалия, гиперэхогенный кишечник, расширение почечных лоханок, внутрисердечный гиперэкогенный фокус, короткая бедренная кость и другие.
Вентрикуломегалия
Расширение желудочков мозга называют вентрикуломегалией. Очень часто ошибочно такое состояние мозга путают с гидроцефалией. Вентрикуломегалия (чаще всего речь идет о боковых (латеральных) расширенных желудочках) встречается как изолированный признак в 30-60% случаев, в остальных – она связана с наличием других пороков развития. Это состояние мозга находят в 0.3-1.5 на 1000 новорожденных.
Причин возникновения вентрикуломегалии несколько. Расширение желудочков может возникать как результат повышения внутричерепного давления, нарушения обмена черепно-мозговой и спинно-мозговой жидкости, из-за поражения тканей мозга. В 5% случаев развитие вентрикуломегалии наследственное (передается через Х-хромомеру), а также может быть проявлением комплексных наследственных синдромов. Первичное заражение рядом инфекций (токсоплазмоз, сифилис, ЦМВ-инфекция, краснуха) может быть причиной возникновения вентрикуломегалии. Чаще всего причина неизвестна.
До 16-18 недель беременности расширение желудочков мозга почти не встречается, поэтому обнаружение вентрикуломегалии бывает чаще всего со второй половины беременности. Так как плод растет, важно учитывать срок беременности и знать его до постановки диагноза. Средние размеры диаметра боковых желудочков составляют 7.6 мм+/- 0.6 мм с 14 по 38 неделю. Если диаметр больше 1 см (10 мм), говорят о вентрикуломегалии.
Различают легкую или пограничную (10-15 мм), среднюю или умеренную (больше 15 мм, но с сохраненной корой мозжечка — больше 3 мм), и тяжелую или острую (размеры желудочков больше 15 мм и кора мозжечка меньше 3 мм) вентрикуломегалии.
Изолированная легкая и средняя вентрикуломегалии не ухудшают исход беременности, однако в 2-3% случаев будут обнаружены хромосомные нарушения, чаще всего синдром Дауна. В ассоциации с другими пороками развития прогноз беременности плохой, сопровождается мертворождением, рождением детей-калек или умственно отсталых.
При обнаружении вентрикуломегалии необходимо провести детальное анатомическое УЗИ, кариотипирование плода и пройти генетическую консультацию. Тактика ведения беременности и родоразрешения будет зависит от результатов обследования – от наблюдения без вмешательства до прерывания беременности.
Гиперэхогенный кишечник
Повышенная эхогенность кишечника плода при проведении УЗИ встречается в 0.1-8% беременностей во втором и третьем триместрах. Некоторые врачи предлагают использовать шкалу эхогенности, чтобы определить степень «нормальности» и отклонений от нормы. Первая степень характеризуется незначительной (слабой) эхогенностью, вторая степень считается умеренной, а третья степень – увеличенной эхогенностью, или гиперэхогенностью.
Причины гиперэхогенности могут быть разными и должны учитываться факторы риска беременности, состояние плода и наличие других отклонений. Чаще всего гиперэхогенность кишечника связывают с инфицированием плода, хромосомными и генетическими аномалиями, гипоксией плода.
В изолированном виде гиперэхогенность кишечника не влияет на прогноз беременности. При наличии других отклонений такой УЗИ-признак сочетается с внутриутробной задержкой роста плода и внутриутробной гибелью плода почти в 25% случаев. В 3-25% случаев гиперэхогенный кишечник встречается при синдроме Дауна, а в 3-5% случаев – при кистозном фиброзе.
При обнаружении гиперэконеного кишечника проводится такое же обследование, как и при обнаружении других мягких УЗИ-признаков, ассоциируемых с хромосомными аномалиями.
Расширение почечных лоханок
Расширение почечных лоханок (пиелоэктазия), одностороннее или двухстороннее, может ассоциироваться со многими диагнозами, в том числе с врожденными пороками и наследственными хромосомными и генетическими синдромами. Его находят в 2% случаев беременности.
Так как размеры плода, в том числе его почек, увеличиваются с прогрессом беременности, до сих пор нет четких критериев постановки диагноза пиелоэктазии. Самый сложный вопрос – какое минимальное расширение почечных лоханок считать за норму. Большинство врачей считают пиелоэктазией расширение почечной лоханки больше 4 мм до 32 недель и больше 7 мм после 36 недель. Расширение почечной лоханки больше 10 мм считается выраженной пиелоэктазией или гидронефрозом. Пиелоэктазия встречается у мальчиков-плодов в два раза чаще, чем у девочек.
Самыми частыми причинами тяжелой пиелоэктазии и гидронефроза является закупорка (непроходимость) мочеточника, когда отток мочи из почки нарушается. Реже встречается непроходимость нижних мочевыводящих путей, чаще всего у мальчиков, из-за наличия уретрального клапана (синдром нижней уретральной обструкции – LUTO). Пиелоэктазия встречается при пороках развития почечной системы и нижних отделов кишечника.
Односторонняя пиелоэктазия, если расширение не превышает 8 мм, проходит самостоятельно в большинстве случаев в третьем триместре или после родов. Если расширение больше, нередко дети нуждаются в обследовании и хирургической коррекции в раннем детстве.
Двухстороннее расширение почечных лоханок требует серьезного подхода в поиске аномалий развития мочевыделительной системы, а также в диагностике хромосомных и других аномалий плода. В тяжелых случаях для сохранения почек проводят прокол почки или мочевого пузыря и дренаж скопившейся мочи, а также шунтирование (введение зонда) для оттока мочи. Часто после родов такие дети требуют хирургическое лечение в первые дни жизни.
Внутрисердечный гиперэхогенный фокус
Внутрисердечный гиперэхогенный фокус представляет собой небольшую структурную область в основании папиллярных (сосочковых) мышц, и его часто описывают как микро кальцинацию или микро минерализацию этого участка. Чаще всего такие изменения находят в левом желудочке, но иногда гиперэхогенный фокус бывает в правом или обеих желудочках.
Изолированный гиперэхогенный фокус встречается в 0.5-20% беременностей. В среднем, до 7% беременностей сопровождаются наличием таких изменений. Считается, что в 17-20% случаев такой диагноз может быть ошибочным из-за технических погрешностей УЗИ-аппарата.
Хотя некоторые врачи утверждают, что такой УЗИ-маркер может ассоциироваться с хромосомными аномалиями, в изолированном виде, то есть при отсутствии других отклонений, внутрисердечный гиперэхогенный фокус не является признаком наличия возможных хромосомных нарушений.
Данные о том, что внутрисердечный гиперэхогенный фокус ассоциируется с синдромом Дауна, противоречивые.
Короткая бедренная кость
Измерение длины бедра у плода проводят со второй половины беременности. О короткой бедренной кости или коротком бедре говорят тогда, когда размеры бедра выходят за пределы 5-10 перцентили. У маленьких плодов и у тех, кто отстает в росте, этот признак может быть проявлением нормы.
В 50% случаев нахождения такого отклонения имеются другие отклонения в развитии, а в 20% случаев находят отклонения в росте плода без наличия аномалий. Слишком короткая бедренная кость может ассоциироваться с скелетной дисплазией (15% случаев) или хромосомными аномалиями, в том числе синдромом Дауна.
Изолированная короткая бедренная кость не ассоциируется с хромосомными аномалиями.
При обнаружении короткой бедренной кости всегда важно уточнить срок беременности, исключить задержку роста плода, наличие других отклонений в развитии и хромосомных аномалий.
