Энтерококки в моче у ребенка что это
Enterococcus faecalis (энтерококк фекальный)

Фекальные энтерококки — самые часто встречающиеся в организме человека и домашней птицы энтероккоки. Фекальные энтерококки также колонизируют кишечник крупного рогатого скота, свиней, собак, лошадей, овец и коз.
Фекальный энтерококк может являться возбудителем различных инфекций: мочевыводящих путей, интраабдоминальных, органов малого таза, раневых, эндокардита. Фекальные энтерококки, наряду с энтерококками вида фэциум являются наиболее патогенными видами среди энтерококков, они составляют 80–90% от всех выделенных в клиническом материале человека энтерококков. Фекальные энтерококки часто бывают причиной внутрибольничных инфекций (Бондаренко В.М. Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции).
Enterococcus faecalis участвуют в реакции трансплантат против хозяина (Карпеева Ю.С. и др.).
В то же время, фекальные энтерококки входят в состав нормальной микрофлоры желудочно-кишечного тракта человека и многих позвоночных, играют важную роль в обеспечении колонизационной резистентности слизистой оболочки. Основное место обитания фекального энтерококка в организме — тонкая кишка, но он также встречается в толстой кишке, губчатой части мочеиспускательного канала, в половых органах, и, иногда, в полости рта. Фекальные энтерококки присутствуют в кале 90 % взрослых людей. Количество фекальных энтерококков во внешней среде является значимым санитарным и эпидемиологическим показателем ее фекальной загрязненности.
Фекальные энтерококки в пищевой промышленности
Инфекция мочевых путей и фекальные энтерококки
Бактериурия — наличие бактерий в моче может является признаком воспаления в мочевыводящих путях, мочевом пузыре, почках. При отсутствии каких-либо симптомов, истинная бактериурия (инфекция мочевых путей) диагностируется при наличии не менее 10 5 микробных тел в 1 мл свежевыпущенной мочи, иначе предполагается, что загрязнение мочи происходит при ее заборе. При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. Часто бактериурия не сопровождается какими-либо симптомами, тогда она называется бессимптомной или асимптоматическая бактериурией. В то же время, бактериурия нередко сочетается с симптомами цистита, пиелонефрита, простатита, уретрита, а также встречается у беременных. Бессимптомная бактериурия не всегда требует немедленного лечения.
Одним из возбудителей воспалений мочевыводящих путей (ВМП) является фекальный энтерококк, на долю которого приходится от 1 до 18 % (в зависимости от типа заболевания) всех выявленных при бактериурии патогенных микроорганизмов. Остальные виды энтерококков практически не встречаются среди возбудителей ВМП.
Активность антибиотиков в отношении Enterococcus faecalis
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Enterococcus faecalis: левофлоксацин, норфлоксацин, офлаксацин, рифаксимин, нифурател, доксициклин (не ко всем штаммам). Enterococcus faecalis умеренно чувствителен к ципрофлоксацину. 74 % штаммов Enterococcus faecalis не чувствительны к тетрациклину. Не активны в отношении Enterococcus faecalis линкомицин и клиндамицин. Чувствительные к ванкомицину и гентамицину штаммы Enterococcus faecalis чувствительны также к моксифлоксацину.
Для лечения острых неосложненных инфекций мочевыводящих путей, вызванных Enterococcus faecalis могут быть рекомендованы нитрофураны, цефалоспорины III поколения, гентамицин, фторхинолоны, последние — с оговоркой о неблагоприятных тенденциях к росту устойчивости. Следует отметить, что цефалоспорины лишены активности против энтерококков, а ранние фторхинолоны (ломефлоксацин, норфлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин) обладают слабой активностью против Enterococcus faecalis.
Enterococcus faecalis в систематике бактерий
По современным представлениям вид Enterococcus faecalis относится к роду Enterococcus (энтерококки), который входит в семейство Enterococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, Terrabacteria group, царство Бактерии.
По принятой ранее классификации энтерококки относились к стрептококкам серогруппы D и Enterococcus faecalis назвался Streptococcus faecalis. Традиционно он иногда называется фекальным стрептококком.
Инфекции нижних мочевых путей у детей: опции и клинические рекомендации
К.И. Крамарева
Детский уролог-андролог ГБУЗ ДГП 133 ДЗМ, главный внештатный специалист по детской урологии-андрологии САО г. Москва
В программе «Час с ведущим урологом» гостем Виктории Анатольевны Шадеркиной стала детской уролог-андролог ГБУЗ ДГП 133 ДЗМ, главный внештатный специалист по детской урологии-андрологии САО г. Москва Ксения Ильинична Крамарева. Она рассказала об особенностях лечения инфекций мочевых путей (ИМП) и, в частности, цистита у детей.
Инфекции мочевых встречаются у детей обоих полов, и являются частой причиной обращения к детскому урологу или педиатру. Бактериурия – это рост количества бактерий в мочевом тракте (более 105 КОЕ/мл), способный привести к развитию воспалительного процесса.
Основными ее возбудителями являются Escherichia сoli, Klebsiella pneumoniae, Proteus mirabilis, Staphylococcus epidermidis и Enterococcus faecalis. При этом этиологический спектр возбудителей острых неосложненных инфекций верхних и нижних отделов мочевыводящих путей (пиелонефрит и цистит) сходен. Доминирующим возбудителем является E. сoli, на долю которой приходится 70–95% случаев заболеваний. В 5–19% выделяются коагулазонегативные стафилококки, главным образцом Staphylococcus saprophyticus. В остальных случаях возбудителями могут быть другие энтеробактерии (Proteus mirabilis, Klebsiella spp.) и энтерококки (Enterococcus faecalis).
К инфекциям мочевыводящих путей у детей, так же как и у взрослых, относятся цистит, уретрит, острый и хронический пиелонефрит, а также уросепсис.
Цистит – это инфекционно-воспалительные заболевание стенки мочевого пузыря бактериального происхождения. Девочки болеют им в три раза чаще мальчиков, а с возрастом повышается относительный риск развития рецидива.
В среднем, рецидивы возникают у 30% девочек в течение одного года после первого эпизода и у 50% – в течение пяти лет после первого эпизода. У мальчиков рецидивы наблюдаются у 15–20% в течение одного года после первого эпизода [Chen J. J. et al., Urology, 2013].
Выделяется ряд факторов риска развития цистита:
Цистит у детей можно классифицировать по путям проникновения инфекции в мочевой пузырь:
Другой вид классификации – по клиническому течению: острый, рецидивирующий и интерстициальный. Также цистит подразделяется по вовлеченности мочевого пузыря в патологический процесс: на первичный и вторичный (вследствие какого-либо заболевания).
По причине развития заболевания цистит делится на инфекционный, аллергический, химический и лучевой. По типу инфекционного возбудителя – на неспецифический (вызванный собственной условно-патогенной микрофлорой) и специфический (хламидии, микоплазмы, уреаплазмы, туберкулез, кандидоз и т. д.).
Острый цистит у детей характеризуется внезапным началом, вызванным каким-либо провоцирующим фактором. Тяжесть проявления симптомов нарастает в течение первых двух суток, а в случае своевременно назначенной терапии наблюдается быстрый регресс. Наиболее распространенные симптомы острого цистита – частое болезненное мочеиспускание, боли внизу живота, появление крови в конце акта мочеиспускания, императивные позывы к мочеиспусканию и связанное с ними ургентное недержание мочи. Иногда возможны боли в нижней области живота и спины, а также повышение температуры тела и озноб. Сложность диагностики у детей младшего возраста заключается в сложности интерпретирования симптомов.
При рецидивирующем течении проявление симптомов заболевания наблюдается не реже двух раз за полгода либо трех раз в течение года. Причинами могут являться реинфекция, прерванное или неправильное лечение, бесконтрольный прием антибиотиков и несоблюдение правил личной гигиены.
Рецидивирующий цистит у детей является следствием предшествующего воспалительного заболевания и носит вторичный характер. Клинические симптомы схожи с таковыми при остром цистите. Возможен вариант течения с минимальными жалобами и постоянными лабораторными признаками (лейкоцитурия, бактериурия), с отсутствием гипертермии.
Основные моменты диагностики цистита – тщательный сбор анамнеза, особенно у детей младшего возраста, активная беседа с родителями или законными представителями. Не существует никаких шаблонов бесед с ребенком или его родными – все очень индивидуально. При беседе с детьми старшего возраста необходимо получить информацию о возможных половых контактах. Лабораторные методы включают общий анализ мочи, посев на стерильность и ультразвуковое исследование мочевых путей.
При проведении общего анализа мочи могут выявляться лейкоцитурия, бактериурия, эритроцитурия, присутствие эпителия и цилиндров. Также возможна ложная протеинурия, обусловленная распадом большого количества форменных элементов крови.
При подозрении на наличие воспалительного процесса в мочевыводящих органах, рецидивирующем течении заболевания или асимптомной бактериурии при наличии жалоб назначается бактериальный посев мочи с определением чувствительности к антибиотикам. Он важен как для определения непосредственно чувствительности патогенной микрофлоры к антибиотикам, так и для контроля эффективности антибактериального лечения.
При назначении ультразвукового исследования мочевых путей важно помнить, что изменения мочевого пузыря на УЗИ не являются специфичными и должны быть подтверждены клинической картиной и данными лабораторных исследований.
Во всех случаях, особенно у детей раннего возраста, необходимо проводить дифференциальную диагностику острого цистита с острым пиелонефритом. Так, при цистите температура редко поднимается выше 38 °С, могут отсутствовать симптомы интоксикации и боли в пояснице, которые всегда сопровождают острый пиелонефрит. Вместе с тем при цистите всегда присутствует дизурия, зачастую – гематурия. При пиелонефрите также характерны изменения в анализах крови.
Также в некоторых случаях требуется дифференциальная диагностика с нейрогенной дисфункцией мочевого пузыря, вульвовагинитом и дисметаболической нефропатией. Не стоит забывать и о том, что эти заболевания могут присутствовать и параллельно с циститом.
Ключевые моменты в лечении цистита у детей – устранение симптомов и бактериурии в остром периоде, предотвращение развития рубцовых изменений стенки мочевого пузыря, а также профилактика рецидивов.
Ксения Ильинична выделила несколько основных элементов лечения цистита:
Согласно алгоритму терапии неосложненного цистита эмпирически назначаются фосфомицина трометамол (с 5 лет) и нитрофурантоин. Через 3 дня и 12 недели проводятся повторные осмотры.
При неэффективности выполняется посев мочи и проводится коррекция терапии. Однако следует помнить, что даже при успешном лечении необходима дальнейшая профилактика рецидивов. В частности, с этой целью после уменьшения выраженности симптоматики назначается фитотерапия.
Более длительный курс антибиотикотерапии показан при лечении цистита у пациентов с факторами риска рецидивирования и хронизации инфекции. К ним следует отнести случаи сохранения клинической симптоматики более семи дней, а также наличие у пациентов сахарного диабета и других нарушений обмена веществ.
В последние годы наблюдаются отчетливые тенденции роста устойчивости уропатогенных штаммов E. Coli к антибактериальным препаратам, которые традиционно широко назначаются при внебольничных инфекциях мочевыводящих путей: ампициллину (устойчивость > 30%) и ко-тримоксазолу (устойчивость 2030%). Наименьший уровень устойчивости E. Coli наблюдается к гентамицину и фосфомицину [Hooton T.M. et al. Clin Infect Dis, 2004; Wiedermann B. Clin Drug Invest, 2001].
Говоря о лечении цистита, необходимо отметить терапевтические возможности применения препаратов неантибактериальной природы в составе комплексной терапии. Так, в 2015 г. Всемирная организация здравоохранения опубликовала Глобальный план действий по устойчивости к противомикробным препаратам, который в значительной мере способствовал росту интереса научного сообщества к использованию неантибиотических методов лечения и профилактики рецидивирующих инфекций мочевых путей, включающих использование D-маннозы, пробиотиков и биологически активных веществ, содержащихся в плодах клюквы.
Витамин С создает кислую среду в мочевом пузыре. Это важная часть борьбы с бактериями, так как для жизнедеятельности и размножения им требуется щелочная среда. Витамин является антиоксидантом, а это значит, что он уменьшает последствия воспаления в клетках мочевого пузыря и способствует скорейшему заживлению и восстановлению его стенок.
Перечисленные вещества могут употребляться в составе фитотерапевтических препаратов. В частности, все три упомянутых компонента содержит препарат Цистениум II. При включении в схему комплексной терапии рецидивирующего цистита он снижает вероятность развития рецидивов и повышает эффективность антибактериального лечения. При этом растительные компоненты не вызывают резистентности у бактерий, поэтому эффективность препарата не снижается при частом применении. Препарат может применяться в комплексной терапии совместно с антибиотиками, курсом, а также для профилактики во время появления провоцирующих цистит факторов. Цистениум II разрешен для применения у беременных и детей старше 7 лет. Его принимают по 1 таблетке 1-2 раза в день во время еды. Один прием препарата следует запланировать на вечернее время, так как ночью наблюдается застой мочи и возникает благоприятная среда для размножения микроорганизмов. Как подчеркнула Ксения Ильинична, только этот препарат среди других средств этой же категории содержит в себе все три активных компонента.
Важна и нелекарственная профилактика циститов: исключение переохлаждений, соблюдение личной гигиены, регулярное посещение туалета и лечение очагов хронической инфекции в организме.
Материал подготовила В.А. Шадеркина
Выступление можно посмотреть на Uro. TV в разделе «Час с ведущим урологом»
Энтерококки
Темой сегодняшнего разговора будут одни из наиболее распространенных микроорганизмов из семейства Enterobacteriaceae — энтерококки, которые являются грамположительными кокками и факультативными анаэробами.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будут одни из наиболее распространенных микроорганизмов из семейства Enterobacteriaceae — энтерококки, которые являются грамположительными кокками и факультативными анаэробами.
Микробиологические аспекты
Энтерококки входят в состав нормальной микрофлоры кишечника, обитают в основном в тонкой кишке и при этом, обнаруживаясь за пределами своей естественной среды обитания, являются возбудителями множества социально-значимых заболеваний. Наибольшее клиническое значение имеют E.faecalis и E.faecium.
Отличительным свойством энтерококков является их способность к образованию биопленок. О биопленках достаточно подробно мы рассуждали в статье, посвященной синегнойной палочке. И специфика течения многих заболеваний, вызванных энтерококками, объясняется именно пленкообразованием.
Клинические аспекты
Наиболее частым возбудителем внебольничных инфекций является E.faecalis — сюда относятся инфекции мочевыводящих путей и инфекционные эндокардиты у внутривенных наркозависимых пациентов.
E.faecium наиболее часто выявляется при нозокомиальных инфекциях — здесь преобладают так же инфекции мочевыводящих путей, но связанные с проведением инструментальных методов исследования, а также всевозможные виды бактеремий, связанных с медицинскими вмешательствами.
Когда мы можем думать о состояниях, вызванных энтерококками?
Существуют следующие факторы риска инфицирования энтерококками:
Как мы можем заметить, основную роль в развитии заболеваний, вызванных энтерококками, играет человеческий, точнее ятрогенный фактор. Энтерококки, как и вся остальная кишечная микрофлора, по воздуху летать не умеют, да и ножками не ходят, а потому главное в их нераспространении — чистота наших рук и соблюдение санитарно-противоэпидемических правил, написанных, как и большинство подобных документов (например, как ПДД), кровью, причем кровью пациентов.
Аспекты лечения
Их можно разделить на лекарственные и нелекарственные.
Аспекты медикаментозного лечения
Здесь автор отступит от правила и не отправит изучать вопрос по книжкам и таблицам, а попытается расписать антибактериальную терапию более подробно. Это связано и со спецификой самого возбудителя, и со спецификой контингента, имеющего заболевания, им вызванные.
Как уже упоминалось ранее, наряду с зеленящим стрептококком, а вообще намного чаще, энтерококк является основным возбудителем инфекционного эндокардита у лиц с внутривенной наркотической зависимостью. Проще говоря, если перед вами наркозависимый, и у него эндокардит трикуспидального клапана, то первое, о чем вы должны подумать, — это энтерококк, и эмпирическую терапию назначать с учетом этого знания. Конечно, могут быть варианты в виде того же зеленящего стрептококка или даже золотистого стафилококка, но эти возбудители более присущи пациентам с несанированной ротовой полостью и на митральном клапане (зеленящий) или после кардиохирургического вмешательства (золотистый стафилококк). Также на стафилококковый, а не энтерококковый характер поражения будет намекать снимок органов грудной клетки в прямой проекции, подозрительно напоминающий решето (один раз увидев стафилококковую метастатическую пневмонию ее уже ни с чем не перепутаешь).
Чем будем лечить?
Как ни странно это прозвучит в современных условиях, но препаратами выбора будут представители аминопенициллинового ряда — ампициллин (дешевле) или амоксициллин (в разы дороже) в обязательной комбинации с аминогликозидом — гентамицином (этот дешевле) или амикацином. Поэтому если вы работаете в стационаре скорой помощи и у вас попадаются пациенты данной категории — ампициллин для инъекций крайне рекомендуется иметь на полках аптеки в достаточных количествах. Это до сих пор дешево, сердито и очень эффективно в случаях терапии энтерококковых инфекций почти любой этиологии, и главное правильно рассчитать дозу, так как аминопенициллины относятся к так называемым время-зависимым препаратам (читаем первую и вторую часть здесь).
Повторимся еще раз — аминопенициллины в данном случае должны использоваться только в комбинации с аминогликозидами ввиду их синергетического действия в отношении энтерококков и ввиду вероятности микст-инфекции у подобной категории пациентов.
Вопрос по эмпирическому использованию ванкомицина остается дискуссионным — если в случае E.faecalis его можно назначать на уровне эмпирической терапии, когда у пациента имеется документированная аллергия на пенициллины (если конечно вам покрасили мазок по Граму или ваш стационар настолько крут, что имеет свой масс-спектрометр), то в случае E.faecium даже начинать не стоит — сразу зовите специально обученного человека, пусть он думает, что дальше делать.
Как уже было выше упомянуто, цефалоспорины назначать не стоит — энтерококки к ним природно устойчивы. А для того чтобы рука потянулась к карбопенемам, вам надо иметь доказанную мульти-резистентность возбудителя.
В случае развития резистентности к ампициллину используется его защищенная форма в виде ампициллина/сульбактама в комбинации с гентамицином. Дозировки рассчитываются по ампициллину.
Если совсем не повезло и лаборатория дала мультирезистентного фекального энтерококка, то используется комбинация ванкомицин (15 мг/кг/сут) в комбинации с гентамицином (8 мг/кг/сут) под жесточайшим контролем функции почек. Кроме того, в случае мультирезистентного возбудителя может быть использована комбинация имипенема с ампициллином, если, конечно, сможете обосновать ее для страховой компании — автор обосновывала, необходимый эффект получала, пациент не только выживал, но и выздоравливал. Только призывать к такого рода схемам, описанным, в основном, в американской литературе, автор ни в коем случае не будет, особенно в нынешние неспокойные времена. Сейчас наши основные документы по назначению любого вида терапии располагаются здесь.
В случае обнаружения резистентного E.faecium препаратом выбора становится линезолид и, не побоюсь этого слова, молитва, так как срок лечения не менее 8 недель, а кто нам столько препарата выдаст, да и прогноз при применении бактериостатика как-то не очень.
На этом краткий обзор энтерококковых инфекций закончим, и из кишечной микрофлоры у нас останется только королева внтурибольничных инфекций — ее величество Klebsiella, о которой мы поговорим в одной из следующих публикаций.
Инфекция мочевой системы у детей
Термином «инфекция мочевой системы» (ИМС) обозначается воспалительный процесс в мочевой системе без специального указания на этиологию и локализацию (мочевые пути или почечная паренхима) и определения его характер
Термином «инфекция мочевой системы» (ИМС) обозначается воспалительный процесс в мочевой системе без специального указания на этиологию и локализацию (мочевые пути или почечная паренхима) и определения его характера.
Термин «инфекция мочевой системы» объединяет все инфекционно-воспалительные заболевания органов мочевой системы (ОМС) и включает в себя пиелонефрит (ПН), цистит, уретрит и асимптоматическую бактериурию. Таким образом, это групповое понятие, но не нозологическая форма. Соответственно, постановка диагноза «инфекция мочевой системы» возможна только на начальных этапах обследования, когда выявляются изменения в моче (лейкоцитурия и бактериурия), но нет указаний на локализацию воспалительного процесса. В дальнейшем такие дети требуют полноценного нефроурологического обследования и определения уровня поражения ОМС, после чего устанавливается более точный диагноз (цистит, ПН и т. д.). Такой подход оправдан еще и потому, что соответствует этапности выявления патологии, принятой в педиатрической службе нашей страны. Первые признаки инфекционно-воспалительных заболеваний ОМС, как правило, выявляются на доклиническом этапе (амбулаторно-поликлиническая служба, скоропомощная служба), когда, в большинстве случаев, нет возможности установить точную локализацию процесса. Поэтому правомочна постановка диагноза «инфекция мочевых путей или мочевой системы». В дальнейшем, в специализированном стационаре, диагноз уточняется.
В отечественной литературе встречаются различные термины для обозначения инфекционного процесса в ОМС: «инфекция ОМС», «мочевая инфекция», «инфекция мочевыводящих путей» и т. п. При этом в каждое название вкладывается определенный смысл. Например, «инфекция ОМС» и «мочевая инфекция» подразумевает возможность локализации инфекции в любом отделе ОМС или тотальное поражение почек и мочевыводящих путей; «инфекция мочевыводящих путей» подразумевает инфицирование только мочевыводящих путей, но не почек и т. д. Такое разнообразие терминов вносит определенную путаницу, тем более что любой из подобных диагнозов все равно требует обследования и уточнения локализации. На наш взгляд, для удобства целесообразно считать термины «инфекция мочевых путей», «инфекция ОМС» и т. д. синонимами, подразумевая при этом, что любой из них не может являться окончательным и требует уточнения.
Однако подобный подход не совсем соответствует МКБ-10 (1995 г.). По рекомендации экспертов ВОЗ, заложенной в основу МКБ-10, инфекция мочевых путей является самостоятельной нозологической единицей и подразумевает заболевание, при котором нет данных о поражении паренхимы почек, но есть признаки транзиторного воспаления нижних мочевых путей, определить локализацию которого в момент обследования невозможно. Таким образом, понятие «инфекции мочевых путей» сужается до поражений мочевого пузыря и уретры и исключает ПН, который по МКБ-10 относится к группе тубуло-интерстициальных нефритов.
Такое узкое толкование термина имеет свои следствия. Во-первых, это подразумевает, что диагноз «инфекции мочевых путей» может быть установлен только в стационаре после комплексного нефроурологического обследования. Во-вторых, лечение может и должно быть назначено и без установленной локализации инфекционно-воспалительного процесса. В-третьих, фактически «инфекция мочевых путей» сводится к транзиторной лейкоцитурии и бактериурии на фоне основного интеркуррентного заболевания (бронхит, пневмония, ОРВИ, ангина и др.) и быстро исчезает на фоне лечения основного заболевания и антибактериальной терапии. Поэтому и курсы антибактериальных препаратов должны быть короткими (5–7 дней).
Не претендуя на объективность, мы считаем более удобным использование термина «инфекция мочевых путей» в соответствии с отечественной традицией, т. к. подобное понимание является повсеместно распространенным среди педиатров нашей страны и больше соответствует структуре педиатрической и детской нефрологической службы. Кроме того, инфекционные поражения органов мочевой системы связаны общностью этиопатогенеза и терапевтической тактики.
Эпидемиология
Распространенность ИМС в популяции достаточно велика и составляет до 80% всех заболеваний ОМС. Среди всех заболеваний инфекционной этиологии ИМС занимает второе место после ОРВИ.
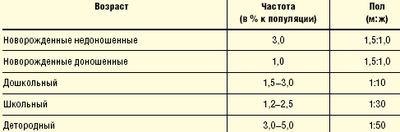
Распространенность ИМС зависит от возраста и пола (табл. 1). Если в периоде новорожденности мальчики болеют в полтора раза чаще девочек, то в последующие месяцы эти показатели уравниваются, к 1 году частота ИМС среди девочек уже в 4 раза больше, а после года жизни частота встречаемости ИМС у девочек в десятки раз превышает таковую у мальчиков. Среди пациентов детородного возраста у женщин ИМС встречается в 50 раз чаще, чем у мужчин (исключая уретриты и простатиты). Это приводит нас к выводу, что фактически ПН и циститы — это «женские» заболевания. В детском возрасте распространенность ПН достигает 20–22 случаев на 1000 детей (М. В. Эрман, 1997).
Терминология
ПН — неспецифическое, острое или хроническое микробное воспаление в чашечно-лоханочной системе и интерстициальной ткани почек с вовлечением в патологический процесс канальцев, кровеносных и лимфатических сосудов.
Цистит — микробно-воспалительный процесс в стенке мочевого пузыря (как правило, в слизистом и подслизистом слое).
Асимптоматическая бактериурия — состояние, когда при полном отсутствии клинических проявлений заболевания бактериурия выявляется одним из нижеперечисленных способов: 10 и более микробных тел в 1 мл мочи; или более 105 колоний микроорганизмов одного вида, выросших при посеве 1 мл мочи, взятой из средней струи; или 103 и более колоний микроорганизмов одного вида при посеве 1 мл мочи, взятой катетером; или любое количество колоний микроорганизмов при посеве 1 мл мочи, полученной путем надлобковой пункции мочевого пузыря.
Наличие бактерий в общем анализе мочи не является достоверным критерием бактериурии.
Пути проникновения инфекции в мочевую систему
Возбудитель может попасть в ОМС тремя путями: гематогенным, лимфогенным и восходящим.
Лимфогенный путь попадания возбудителей связан с общей системой лимфообращения между ОМС и кишечником. В норме лимфа оттекает от почек и мочевыводящих путей к кишечнику, поэтому распространение бактерий из полости кишечника к ОМС по лимфатическим сосудам исключается; более того, сама слизистая кишечника является барьером для проникновения микроорганизмов в кровь и лимфу. Однако в условиях нарушения барьерных свойств слизистой оболочки кишки и лимфостаза вероятность инфицирования ОМС флорой кишечника многократно возрастает. Такая ситуация возникает при длительно существующей диспепсии (диареях и, особенно, хронических запорах), колитах, инфекционных заболеваниях кишечника, нарушениях его моторики и дисбактериозах. При лимфогенном пути проникновения инфекции из мочи будут высеваться представители кишечной микрофлоры.
Восходящий путь распространения инфекции является доминирующим. Анатомическая близость уретры и ануса приводит к тому, что в периуретральной зоне всегда имеется большое количество бактерий, попадающих из области ануса. Особенности строения наружных половых органов у девочек и более короткая уретра создают наиболее благоприятные условия для проникновения бактерий в ОМС восходящим путем, что обуславливает более высокую частоту ИМС. Поэтому очень важным является правильный и регулярный туалет промежности (подмывание от вульвы к анусу), привитие девочке с раннего детства навыков личной гигиены. Основными возбудителями при восходящем пути являются представители микрофлоры кишечника.
Этиологическая структура ИМС
Наиболее часто при ИМС высеваются представители семейства Enterobacteriacae, а среди них — кишечная палочка (E. coli), доля которой по данным разных авторов колеблется от 40 до 90%.
Многоцентровое исследование АРМИД, проводимое в различных центрах нашей страны в 2000–2001 гг., выявило, что в 57% случаев возбудителем внебольничной ИМС у детей является кишечная палочка, в 9% — протей, в 9% — энтерококки, в 9% — клебсиеллы, в 6% — энтеробактеры, в 6% — синегнойная палочка и в 4% — стафилококки (Страчунский Л. С., Коровина Н. А., Папаян А. В. с соавт., 2001).
Следует также учитывать изменение состава возбудителей с возрастом пациента. Так, если у новорожденных и детей первого года жизни в 75–85% возбудителем при ПН являяется кишечная палочка, то у мальчиков доля ее в дальнейшем снижается до 33% и возрастает роль Proteus (до 33%) и St. aureus (до 12%); тогда как у девочек до 10 лет также часто высевается кишечная палочка (до 85%), а после 10 лет — кишечная палочка (до 60%) и St. aureus (до 30%). Сводные данные по этиологической структуре ПН у детей приведены в табл. 2.
Состав высеваемой микрофлоры при хроническом течении ПН имеет некоторые особенности. При этом повышается роль микробных ассоциаций, наличие которых может рассматриваться как один из факторов хронизации (табл. 3). Помимо этого особенностью результатов посевов при хроническом ПН является более низкое, чем при остром, количество высеваемых микроорганизмов. По данным некоторых авторов диагностически значимая бактериурия выявляется при остром ПН в два раза чаще, чем при хроническом. Однако при этом доля грамположительной флоры у детей с хроническим ПН выше. Помимо этого, при хроническом ПН намного чаще обнаруживаются L-формы бактерий.
Определенную роль в генезе ИМС играют вирусы (аденовирус, грипп, Коксаки А и др.). Острая вирусная инфекция или персистенция вирусов в почечной ткани вызывает повреждение уроэпителия, снижение местной резистентности, нарушение микроциркуляции и пр., способствуя таким образом проникновению бактерий в ОМС.
Предрасполагающие факторы и группы риска
Развитие инфекционно-воспалительного процесса в мочевой системе, как правило, происходит при наличии предрасполагающих факторов со стороны макроорганизма, основным из которых является обструкция току мочи на любом уровне.
Нормальная уродинамика является одним из факторов, препятствующих восходящему распространению микроорганизмов и их адгезии на поверхности эпителия. Поэтому любое анатомическое или функциональное нарушение тока мочи можно рассматривать как благоприятный фактор для развития инфекции.
Мочевая обструкция имеет место при всех вариантах аномалий развития и структуры органов мочевой системы, при кристалурии и мочекаменной болезни и др.
Функциональные нарушения моторики мочевых путей (гипо-, гиперкинезия), даже кратковременные, способствует застою мочи, создавая условия для адгезии микроорганизмов и колонизации эпителия. Функциональная обструкция может возникать при абсолютно нормальном строении органов мочевой системы, ее провоцируют переохлаждения, заболевания кишечника, интоксикации, стрессы и т. п.
Помимо обструкции тока мочи развитию ИМС будут способствовать генетические факторы, обменные нарушения, хронические заболевания кишечника, снижение общего и местного иммунитета и пр.
Большей склонностью к развитию ИМС обладают представители III (В0) и IV (АВ) групп крови, т. к. у них на поверхности уроэпителия обнаруживаются рецепторы для фиксации бактерий.
Все это позволяет выделить условные группы риска по развитию инфекции органов мочевой системы:
Варианты течения ИМС
При всем многообразии клинико-лабораторных проявлений инфекции органов мочевой системы можно условно выделить три варианта ее течения.
Клинические проявления заболевания отсутствуют. При исследовании мочи выявляются: бактериальная лейкоцитурия, абактериальная лейкоцитурия, изолированная бактериурия. Возможные причины: инфекционное поражение на любом уровне мочеполовой системы — асимптоматическая бактериурия, латентная инфекция нижних мочевых путей, латентное течение ПН, вульвит, баланит, фимоз и др.
Клинические проявления в виде дизурии (боль при мочеиспускании, поллакиурия, недержание или неудержание мочи и др.); боль или дискомфорт в надлобковой области. Мочевой синдром в виде бактериальной лейкоцитурии (возможно в сочетании с гематурией различной степени выраженности) или абактериальной лейкоцитурии. Возможные причины: цистит, уретрит, простатит.
Клинические проявления в виде лихорадки, симптомов интоксикации; боль в пояснице, боку, животе, с иррадиацией в пах, внутреннюю поверхность бедра. Мочевой синдром в виде бактериальной лейкоцитурии или абактериальной лейкоцитурии, иногда умеренная гематурия. Изменения в крови: лейкоцитоз, нейтрофилез со сдвигом влево, ускорение СОЭ. Возможные причины: ПН, ПН с циститом (при дизурии).
Особенности течения ПН
В клинике ПН у детей раннего возраста преобладают симптомы интоксикации. Возможно развитие нейротоксикоза, появление менингеальной симптоматики, частых срыгиваний и рвоты на высоте интоксикации. Нередко у детей первого года жизни возможен полный отказ от еды с развитием гипотрофии. При осмотре обращает на себя внимание бледность кожных покровов, периорбитальный цианоз, возможна пастозность век.
Часто ПН в раннем возрасте протекает под разнообразными «масками»: диспептические расстройства, острый живот, пилороспазм, кишечный синдром, септический процесс и др. При появлении подобной симптоматики необходимо исключить наличие инфекции мочевой системы.
У детей старшего возраста «общеинфекционные» симптомы проявляются менее резко, нередко возможны «беспричинные» подъемы температуры на фоне обычного самочувствия. Для них характерна лихорадка с ознобом, симптомы интоксикации, постоянные или периодические боли в животе и поясничной области, положительный симптом поколачивания. Возможно течение ПН под «маской» гриппа или острого аппендицита.
Особенности течения цистита
У детей старшего возраста и взрослых цистит чаще всего протекает как «местное страдание», без лихорадки и симптомов интоксикации. При геморрагическом цистите ведущим в мочевом синдроме будет гематурия, иногда макрогематурия.
У детей грудного и раннего возраста цистит часто протекает с симптомами общей интоксикации и лихорадкой. Для них характерно частое развитие странгурии (задержки мочи).
Для диагностики инфекции органов мочевой системы используются лабораторные инструментальные методы исследования.
Обязательные лабораторные исследования:
Дополнительные лабораторные исследования:
Обязательные лабораторные исследования:
Дополнительные лабораторные исследования:
Принципы терапии инфекционных заболеваний органов мочевой системы
Лечение микробно-воспалительных заболеваний органов мочевой системы предусматривает не только проведение антибактериальной, патогенетической и симптоматической терапии, но и организацию правильного режима и питания больного ребенка. Тактика лечения будет рассмотрена на примере ПН как наиболее тяжелого инфекционного заболевания ОМС.
Вопрос о госпитализации при ПН решается в зависимости от тяжести состояния ребенка, риска развития осложнений и социальных условий семьи. Во время активной стадии заболевания при наличии лихорадки и болевого синдрома назначается постельный режим на 5–7 суток. При цистите и асимптоматической бактериурии госпитализации как правило не требуется. В этот период ПН используется стол № 5 по Певзнеру: без ограничения соли, но с повышенным питьевым режимом, на 50% больше возрастной нормы. Количество соли и жидкости ограничивается только при нарушении функции почек. Рекомендуется чередовать белковую и растительную пищу. Исключаются продукты, содержащие экстрактивные вещества и эфирные масла, жареные, острые, жирные блюда. Выявляемые обменные нарушения требуют специальных корригирующих диет.
Медикаментозная терапия ИМС включает антибактериальные препараты, противовоспалительную десенсибилизирующую и антиоксидантную терапию.
Проведение антибактериальной терапии основывается на следующих принципах:
Терапия ПН включает несколько этапов: этап подавления активного микробно-воспалительного процесса с использованием этиологического подхода, этап патогенетического лечения на фоне стихания процесса с использованием антиоксидантной защиты и иммунокоррекции, этап противорецидивного лечения. Терапия острого ПН, как правило, ограничивается первыми двумя этапами, при хроническом включаются все три этапа лечения.
При выборе антибактериальных препаратов необходимо учитывать следующие требования: препарат должен быть активен в отношении наиболее часто встречающихся возбудителей инфекции мочевой системы, не быть нефротоксичным, создавать высокие концентрации в очаге воспаления (в моче, интерстиции), оказывать преимущественно бактерицидное действие, обладать активностью при значениях рН мочи больного (табл. 4); при сочетании нескольких препаратов должен наблюдаться синергизм.
Длительность антибактериальной терапии должна быть оптимальной, обеспечивающей полное подавление активности возбудителя; обычно составляет в стационаре около 3–4 недель со сменой антибиотика каждые 7–10 дней (или заменой на уросептик).
Стартовая антибактериальная терапия назначается эмпирически, исходя из наиболее вероятных возбудителей инфекции. При отсутствии клинического и лабораторного эффекта через 2–3 дня необходимо сменить антибиотик. При манифестном тяжелом и среднетяжелом течении ПН препараты вводят преимущественно парентерально (внутривенно или внутримышечно) в условиях стационара. При легком и в ряде случаев среднетяжелом течении ПН стационарное лечение не требуется, антибиотики вводятся перорально, курс лечения составляет от 14 до 20 дней.
Некоторые антибиотики, применяемые при стартовой терапии ПН:
– Амоксициллин и клавулановая кислота:
– Аугментин — 25–50 мг/кг/сут, внутрь — 10–14 дней;
– Амоксиклав — 20–40 мк/кг/сут, внутрь — 10–14 дней.
– Цефуроксим (Зинацеф, Кетоцеф, Цефурабол), цефамандол (Мандол, Цефамабол) — 80–160 мг/кг/сут, в/в, в/м — 4 раза в сутки — 7–10 дней.
– Цефотоксим (Клафоран, Клафобрин), цефтазидим (Фортум, Вицеф), цефтизоксим (Эпоцелин) — 75–200 мг/кг/сут, в/в, в/м — 3–4 раза в сутки — 7–10 дней;
– Цефоперазон (Цефобид, Цефоперабол), цефтриаксон (Роцефин, Цефтриабол) — 50–100 мг/кг/сут, в/в, в/м — 2 раза в сутки — 7–10 дней.
– Гентамицин (Гарамицин, Гентами-цина сульфат) — 3,0–7,5 мг/кг/сут,в/м, в/в — 3 раза в сутки — 5–7 дней;
– Амикацин (Амицин, Ликацин) — 15–30 мг/кг/сут, в/м, в/в — 2 раза в сутки — 5–7 дней.
В период стихания активности ПН антибактериальные препараты вводят преимущественно перорально, при этом возможна «ступенчатая терапия», когда перорально дается тот же препарат, что и вводился парентерально, или препарат той же группы.
Наиболее часто в этот период используются:
– Амоксициллин и клавулановая кислота (Аугментин, Амоксиклав).
– Цефаклор (Цеклор, Верцеф) — 20–40 мг/кг/сут.
– Цефтибутен (Цедекс) — 9 мг/кг/сут, однократно.
– Нитрофурантоин (Фурадонин) — 5–7 мг/кг/сут.
– Налидиксовая кислота (Неграм,Невиграмон) — 60 мг/кг/сут;
– Пипемидовая кислота (Палин, Пимедель) — 0,4–0,8 г/сут;
– Нитроксолин (5-НОК, 5-Нитрокс) — 10 мг/кг/сут.
При тяжелом септическом течении, микробных ассоциациях, полирезистентности микрофлоры к антибиотикам, при воздействии на внутриклеточные микроорганизмы, а также для расширения спектра антимикробного действия при отсутствии результатов посевов используется комбинированная антибактериальная терапия. При этом комбинируются бактерицидные антибиотики с бактерицидными, бактериостатические с бактериостатическими антибиотиками. Некоторые антибиотики в отношении одних микроорганизмов действуют бактерицидно, в отношении других — бактериостатически.
К бактерицидным относятся: пенициллины, цефалоспорины, аминогликозиды, полимиксины и др. К бактериостатическим — макролиды, тетрациклины, хлорамфеникол, линкомицин и др. Потенциируют действие друг друга (синергисты): пенициллины и аминогликозиды; цефалоспорины и пенициллины; цефалоспорины и аминогликозиды. Являются антагонистами: пенициллины и хлорамфеникол; пенициллины и тетрациклины; макролиды.
С точки зрения нефротоксичности, нетоксичными или малотоксичными являются эритромицин, препараты группы пенициллина и цефалоспорины; умеренно токсичными являются гентамицин, тетрациклин и др.; выраженной нефротоксичностью обладают канамицин, мономицин, полимиксин и др.
Факторами риска нефротоксичности аминогликозидов являются: продолжительность применения более 11 суток, максимальная концентрация выше 10 мкг/мл, сочетание с цефалоспоринами, заболевания печени, высокие уровни креатинина. После курса антибиотикотерапии лечение следует продолжить уроантисептиками.
Препараты наликсидиновой кислоты (Невиграмон, Неграм) назначают детям старше 2 лет. Эти средства являются бактериостатиками или бактерицидами в зависимости от дозы по отношению к грамотрицательной флоре. Их нельзя назначать одновременно с нитрофуранами, которые оказывают антагонистический эффект. Курс лечения составляет 7–10 дней.
Грамурин, производное оксолиновой кислоты, обладает широким спектром действия на грамотрицательные и грамположительные микроорганизмы. Применяется у детей в возрасте от 2 лет курсом 7–10 дней. Пипемидовая кислота (Палин, Пимидель) оказывает влияние на большинство грамотрицательных бактерий и на стафилококки. Назначается коротким курсом (3–7 дней). Нитроксолин (5-НОК) и нитрофураны — препараты широкого бактерицидного действия. Препаратом резерва является офлоксацин (Таривид, Заноцин). Он обладает широким спектром действия, в т. ч. и на внутриклеточную флору. Детям назначается только в случае неэффективности других уросептиков. Применение Бисептола возможно только в качестве противорецидивного средства при латентном течении ПН и при отсутствии обструкции в мочевых органах.
В первые дни заболевания на фоне повышенной водной нагрузки применяют быстродействующие диуретики (Фуросемид, Верошпирон), которые способствуют усилению почечного кровотока, обеспечивают элиминацию микроорганизмов и продуктов воспаления и уменьшают отечность интерстициальной ткани почек. Состав и объем инфузионной терапии зависят от выраженности синдрома интоксикации, состояния больного, показателей гемостаза, диуреза и других функций почек.
Этап патогенетической терапии начинается при стихании микробно-воспалительного процесса на фоне антибактериальных препаратов. В среднем это происходит на 5–7 день от начала заболевания. Патогенетическая терапия включает противовоспалительную, антиоксидантную, иммунокоррегирующую и антисклеротическую терапию.
Комбинация с противовоспалительными препаратами используется для подавления активности воспаления и усиления эффекта антибактериальной терапии. Рекомендуется прием нестероидных противовоспалительных препаратов — Ортофена, Вольтарена, Сургама. Курс лечения составляет 10–14 дней. Применение индометацина в детской практике не рекомендуется вследствие возможного ухудшения кровоснабжения почек, снижения клубочковой фильтрации, задержки воды и электролитов, некроза почечных сосочков.
Десенсибилизирующие средства (Тавегил, Супрастин, Кларитин и др.) назначаются при остром или хроническом ПН с целью купирования аллергического компонента инфекционного процесса, а также при развитии сенсибилизации больного к бактериальным антигенам.
В комплекс терапии ПН включают препараты с антиоксидантной и антирадикальной активностью: Токоферола ацетат (1–2 мг/кг/сут в течение 4 недель), Унитиол (0,1 мг/кг/сут в/м разово, в течение 7–10 дней), Бета-каротин (по 1 капле на год жизни 1 раз в день в течение 4 недель)и др. Из препаратов, улучшающих микроциркуляцию почек, назначаются Трентал, Циннаризин, Эуфиллин.
Противорецидивная терапия ПН предполагает длительное лечение антибактериальными препаратами в малых дозах и проводится, как правило, в амбулаторно-поликлинических условиях. С этой целью используют: Фурагин из расчета 6–8 мг/кг в течение 2 недель, далее при нормальных анализах мочи переход на 1/2–1/3 дозы в течение 4–8 недель; назначение одного из препаратов пипемидовой кислоты, налидиксовой кислоты или 8-оксихинолина по 10 дней каждого месяца в обычных дозировках в течение 3–4 месяцев.
Лечение цистита
Лечение цистита предусматривает общее и местное воздействие. Терапия должна быть направлена на нормализацию расстройств мочеиспускания, ликвидацию возбудителя и воспаления, устранение болевого синдрома. В острую стадию заболевания рекомендуется постельный режим до стихания дизурических явлений. Показано общее согревание больного. На область мочевого пузыря применяется сухое тепло.
Диетотерапия предусматривает щадящий режим с исключением острых, пряных блюд, специй и экстрактивных веществ. Показаны молочно-растительные продукты, фрукты, способствующие ощелачиванию мочи. Рекомендуется обильное питье (слабощелочные минеральные воды, морсы, слабоконцентрированные компоты) после снятия болевого синдрома. Увеличение диуреза уменьшает раздражающее действие мочи на воспаленную слизистую оболочку, способствует вымыванию продуктов воспаления из мочевого пузыря. Прием минеральной воды (Славяновская, Смирновская, Ессентуки) из расчета 2–3 мл/кг за 1 час до еды оказывает слабое противовоспалительное и спазмолитическое действие, изменяет рН мочи. Медикаментозная терапия цистита включает применение спазмолитических, уросептических и антибактериальных средств. При болевом синдроме показано применение возрастных доз Но-шпы, Папаверина, Белладоны, Баралгина.
При остром неосложненном цистите целесообразно использование пероральных антимикробных препаратов, выводящихся преимущественно почками и создающих максимальную концентрацию в мочевом пузыре. Стартовыми препаратами терапии острого неосложненного цистита могут быть «защищенные» пенициллины на основе амоксициллина с клавулановой кислотой. В качестве альтернативы могут использоваться пероральные цефалоспорины 2–3 поколения. При выявлении атипичной флоры используются макролиды, грибов — антимикотические препараты.
Минимальный курс лечения составляет 7 дней. При отсутствии санации мочи на фоне антибактериальной терапии требуется дообследование ребенка. Уросептическая терапия включает применение препаратов нитрофуранового ряда (Фурагин), нефторированных хинолонов (препараты налидиксовой и пипемидовой кислот, производные 8-оксихинолина).
В последние годы для лечения циститов широко применяется фосфомицин (Монурал), принимаемый однократно и обладающий широким антимикробным спектром действия. В острый период заболевания проводят фитотерапию с антимикробным, дубящим, регенерирующим и противовоспалительным эффектом. В качестве противовоспалительного средства используются брусничный лист и плоды, кора дуба, зверобой, календула, крапива, мать-и-мачеха, подорожник, ромашка, черника и др. Регенерирующим эффектом обладают ячмень, крапива, брусничный лист.
Антибактериальная терапия хронического цистита проводится длительно и часто сочетается с местным лечением в виде инстилляций мочевого пузыря. При катаральном цистите используются водный раствор Фурацилина, масло облепихи и шиповника, синтомициновая эмульсия. Инстилляции антибиотиков и уросептиков применяются при геморрагическом цистите. При лечении буллезной и гранулярной формы используется р-р Колларгола и нитрата серебра. Длительность курса составляет 8–10 процедур объемом 15–20 мл, при катаральном цистите требуется 1–2 курса инстилляций, при гранулярном и буллезном — 2–3 курса, интервал между курсами 3 месяца.
При частых рецидивах возможно применение иммуномодулирующих препаратов. Могут быть использованы инстилляции Томицидом (продукт жизнедеятельности непатогенного стрептококка), оказывающего также и бактерицидное действие. Томицид повышает содержание sIgA в слизистой оболочке мочевого пузыря.
В качестве физиотерапии используется электрофорез, токи надтональной частоты, электрическое поле сверхвысокой частоты, аппликации Озокерита или парафина. Физиотерапевтическое лечение рекомендуется повторять каждые 3–4 месяца.
Тактика ведения детей с асимптоматической бактериурией
Решение о применении антибактериальной терапии при асимптоматической бактериурии всегда является сложным для врача. С одной стороны, отсутствие клиники и выраженного мочевого синдрома не оправдывает применения 7-дневного курса антибиотиков и уросептиков из-за возможных побочных эффектов. К тому же врачу часто приходится преодолевать предубежденность родителей против использования антибактериальных препаратов.
С другой стороны, более короткие курсы неэффективны, т. к. лишь сокращают период бактериурии, создавая «мнимое благополучие», и не предотвращают последующего развития клинических симптомов заболевания. Также короткие курсы антибиотиков способствуют возникновению устойчивых штаммов бактерий. В большинстве случаев асимптоматическая бактериурия не требует лечения. Такой больной нуждается в дообследовании и уточнении диагноза.
Антибактериальная терапия необходима в следующих ситуациях: