Энтеропатия что это у детей
Современный взгляд на диагностику и лечение глютеновой энтеропатии у детей раннего возраста
Gluten enteropathy (GE) is one of the most common genetically determined diseases of gastrointestinal tract. Clinical representations of GE, methods of diagnostics of GE and approaches to the treatment of this disease are examined.
Проблема глютеновой энтеропатии (ГЭ) в настоящее время приобретает особую актуальность, учитывая современные данные о ее распространенности. Многие врачи-педиатры убеждены в том, что ГЭ является редким заболеванием детей первых лет жизни, которое имеет типичные клинические проявления синдрома мальабсорбции [1, 5].
Современные эпидемиологические данные указывают на то, что частота встречаемости ГЭ в популяции достигает 1%. Это делает ГЭ одним из наиболее распространенных генетически детерминированных заболеваний желудочно-кишечного тракта. Клинические признаки ГЭ отличаются значительным разнообразием, что затрудняет ее своевременную диагностику [1]. Недостаточное внимание уделяется внекишечным симптомам ГЭ. К ним относятся различные дефицитные состояния (рефрактерная к терапии железодефицитная анемия, остеопороз), кожные проявления (хейлиты, дерматиты), нарушение физического и полового развития. Дети с данной патологией длительно наблюдаются многими специалистами, проходят повторные обследования и получают медикаментозную терапию без существенного эффекта, что негативно сказывается на качестве их жизни и усугубляет прогноз заболевания [2–4].
ГЭ (целиакия) — хроническая генетически детерминированная аутоиммунная Т-клеточно-опосредованная энтеропатия, характеризующаяся стойкой непереносимостью специфических белков эндосперма зерна некоторых злаковых культур с развитием гиперрегенераторной атрофии слизистой оболочки тонкой кишки и связанного с ней синдрома мальабсорбции.
«Токсичными» для больных ГЭ являются проламины (спирторастворимые протеины, богатые глутамином и пролином), а именно: глиадин пшеницы, секалин ржи и хордеин ячменя. Принадлежность к этой группе протеинов авенина овса в последнее время обсуждается, однако в практической деятельности его пока следует относить к числу «токсичных» [4]. В медицинской литературе все опасные для больных ГЭ белки злаковых для краткости обозначают термином «глютен». Пусковым фактором для развития ГЭ является употребление глютена и наличие генетической предрасположенности (диагностированные у пациентов гаплотипы HLA-DQ2 или DQ8) [2].
Клиническая картина глютеновой энтеропатии
Типичные симптомы ГЭ — боли в животе, рвота, снижение аппетита, обильный зловонный стул, диарея, метеоризм, задержка физического развития — чаще встречаются в раннем возрасте, развиваются через 1,5–2 мес после введения в рацион злаковых продуктов, возможно, после инфекционного заболевания. Также характерны учащение актов дефекации, полифекалия, стеаторея, увеличение окружности живота на фоне снижения массы тела, признаки гипотрофии (снижение массы тела, истончение подкожного жирового слоя), снижение мышечного тонуса, утрата ранее приобретенных навыков и умений, гипопротеинемические отеки [4].
В соответствии с последними рекомендациями ESPGHAN (European Society of Paediatric Gastroenterology, Hepatology and Nutrition; Европейское общество детских гастроэнтерологов, гепатологов и диетологов), обследованию на предмет наличия ГЭ подлежат дети и подростки, имеющие следующие состояния или симптомы: хроническая или рецидивирующая диарея, тошнота или рвота, хронический болевой синдром, чувство растяжения, хронический запор, отставание в развитии, потеря веса, задержка роста, задержка полового развития, аменорея, рефрактерная к терапии железодефицитная анемия, спонтанные переломы (остеопения/остеопороз), рецидивирующий афтозный стоматит, герпетиформный дерматит, повышение активности печеночных ферментов, синдром хронической усталости [4]. Диагностика ГЭ в таких случаях обычно незатруднительна, а своевременное назначение безглютеновой диеты довольно быстро приводит к купированию клинических симптомов и нормализации темпов физического и нервно-психического развития ребенка.
Обнаружение одного или нескольких указанных симптомов у ребенка требует обязательного серологического обследования (определения концентрации антител класса IgA к тканевой трансглутаминазе) на амбулаторном этапе. В настоящее время данный тест доступен не во всех медицинских учреждениях. В случае выявления повышенного содержания антител к тканевой трансглутаминазе ребенка направляют на госпитализацию в стационар, располагающий инструментами для прицельной диагностики целиакии для более детального осмотра и проведения эндоскопического исследования двенадцатиперстной и тощей кишки со взятием биопсии на гистологический анализ (обязательно!). Необходимо помнить, что обследование ребенка с подозрением на ГЭ, как серологическое, так и морфологическое, должно быть выполнено строго на фоне обычной диеты!
Диагностика
Диагноз ГЭ ставят на основании:
Инструментальные методы исследования
Пациентам проводят эзофагогастродуоденоинтестиноскопию с биопсией дистальных участков двенадцатиперстной и начальных отделов тощей кишки. Эндоскопические признаки ГЭ: патогномоничных эндоскопических признаков целиакии нет. Описаны следующие общие признаки: отсутствие складок в тонкой кишке (кишка в виде «трубы») и поперечная исчерченность складок [5, 8, 9].
Лабораторные методы исследования
Гистологические признаки глютеновой энтеропатии
В активном периоде ГЭ отмечаются диффузные изменения слизистой оболочки тонкой кишки, которые обозначают как «атрофическая энтеропатия», с укорочением ворсин вплоть до полного исчезновения, а также в виде увеличения глубины крипт и уменьшения числа бокаловидных клеток. Наличие глубоких крипт и повышенная митотическая активность, свидетельствующие о гиперплазии генеративного отдела, служат основанием для установления диагноза «Гиперрегенераторная атрофия» [3–5]. Характерна межэпителиальная лимфоцитарная инфильтрация и лимфоплазмацитарная инфильтрация собственной пластинки слизистой оболочки тонкой кишки, что указывает на наличие текущего иммунологического процесса, вызывающего повреждение энтероцитов ворсинок.
Серологические тесты для диагностики глютеновой энтеропатии
Детям с подозрением на ГЭ для подтверждения диагноза должно быть назначено серологическое исследование. Возможно определение в крови антиглиадиновых (AGA), антиэндомизиальных (AEMA) антител, а также антител к тканевой трансглутаминазе (anti-tTG). Наиболее информативным считается определение антител к клеткам слизистой оболочки кишечника: IgA к тканевой трансглутаминазе (anti-tTG) и IgA к эндомизию (AЕMA). В настоящее время данные тесты, как уже было отмечено выше, доступны не во всех поликлиниках. Наиболее распространенным является определение антиаглиадиновых антител (AGA), но его не рекомендуется использовать вследствие низкой специфичности и чувствительности [3]. Необходимо учитывать, что оценка содержания AGA будет недостоверной у больных с исходно низким значением IgA [7], поэтому следует предварительно произвести определение сывороточного IgA.
Лечение глютеновой энтеропатии
Диета
Единственным методом лечения ГЭ и профилактики ее осложнений является строгая и пожизненная безглютеновая диета! В основе элиминационной диетотерапии лежит полное исключение из рациона питания продуктов, содержащих глютен. Принципиально важен отказ от употребления не только тех продуктов, которые содержат «явный» глютен (хлеб, хлебобулочные и макаронные изделия, пшеничная, манная, ячневая, перловая крупа, полуфабрикаты мясных, рыбных и овощных блюд в панировке, пельмени, вареники и т. п.), но и тех, которые содержат «скрытый» глютен, используемый в качестве пищевых добавок в процессе производства (соусы, кондитерские изделия, чипсы, квас и т. д.) [5, 6]. Родителям необходимо объяснить важность четкого контроля состава продуктов, указанного на упаковке.
В настоящее время на российском рынке существуют безглютеновые продукты, изготавливаемые из «безопасных» злаков, обладающие хорошими вкусовыми качествами и позволяющие разнообразить рацион питания детей. Правильно составленная безглютеновая диета абсолютно полноценна, обеспечивает нормальные темпы роста и развития ребенка, препятствует рецидивам заболевания и предотвращает риск развития серьезных осложнений [1, 5]. Ребенок, соблюдающий безглютеновую диету, должен и может вести обычный образ жизни и не нуждается в постоянных госпитализациях в стационар или постановке его на учет по причине инвалидности.
Дети с ГЭ могут употреблять мясо, рыбу, овощи, фрукты, яйца, молочные продукты, рис, бобовые, гречневую крупу, кукурузу, пшено, шоколад, мармелад, некоторые конфеты, зефир, некоторые сорта мороженого.
Рекомендованы специализированные безглютеновые продукты для питания больных с целиакией. Допустимые уровни глютена составляют
Т. М. Ошева, кандидат медицинских наук
Н. С. Журавлева, кандидат медицинских наук, доцент
О. В. Осипенко, кандидат медицинских наук
ГБОУ ВПО УГМА МЗ РФ, Екатеринбург
Контактная информация об авторах для переписки: t_stihina@e1.ru
Энтеропатии
МКБ-10
Общие сведения
Энтеропатии – это группа заболеваний, развивающихся при нарушении активности и полном отсутствии выработки определенных ферментов, которые участвуют в переваривании или всасывании различных компонентов пищи. По сравнению с другими гастроэнтерологическими заболеваниями, энтеропатии являются достаточно редкой патологией. Распространенность различных форм данной патологии весьма варьирует, достоверных эпидемиологических исследований по энтеропатиям в мире не проводилось. Изучением причин развития заболевания, разработкой новых диагностических и лечебных методов занимается клиническая гастроэнтерология.
Причины энтеропатий
Большинство энтеропатий хорошо известны и изучены. Они могут иметь врожденный или приобретенный характер.
1. Приобретенные энтеропатии могут возникать при:
2. Наследственные энтеропатии, например, целиакия, или глютеновая непереносимость, развивается при генетически обусловленном нарушении выработки ферментов для переваривания глютена в кишечнике. В результате при приеме злаковых продуктов, таких как рожь, пшеница и овес, у больного прогрессирует энтеропатия, сопровождающаяся диареей и нарушением переваривания в тонкой кишке.
Однако не все виды энтеропатий имеют четкую причину. Некоторые формы болезни протекают более тяжело и имеют худший прогноз. К подобным заболеваниям относятся коллагеновая спру, аутоиммунная энтеропатия, болезнь Крона, рефрактерная и гипогаммаглобулинемическая спру, эозинофильный гастроэнтерит, а также экссудативная и посттрансплантационная энтеропатия.
Из представленных выше болезней чаще всего встречается экссудативный вариант патологии тонкого кишечника, который может быть либо первичным, либо вторичным на фоне лимфангиоэктазии. Вторичная экссудативная энтеропатия развивается на фоне нарушения оттока лимфы в кишечнике, обусловленного онкологическими или воспалительными заболеваниями. Как правило, данная патология прогрессирует при поражении сосудов брюшной полости, недостаточности правого желудочка и болезни Уиппла.
Патогенез
Энтеропатии могут быть первичными (врожденными) или вторичными (приобретенными). Первичные формы носят наследственный характер, а их развитие обусловлено генетическими мутациями в одном или нескольких генах. Вторичные формы возникают при наличии воспалительных или дистрофических изменений в слизистом слое тонкой кишки.
При прогрессировании патологических процессов в слизистой оболочке тонкого кишечника развиваются воспалительные изменения. В последующем на фоне хронического воспаления может возникать атрофия ворсинчатого слоя и эрозии слизистой.
Симптомы энтеропатий
Клиника энтеропатий, независимо от их этиологии, включает синдром хронической диареи и синдром нарушения всасывания. При наличии ферментопатии понос возникает на фоне употребления продуктов, к которым имеется непереносимость. При обострении кал приобретает жидкий и пенистый характер. В нем можно обнаружить непереваренные остатки пищи, а также большое количество жиров, белков и углеводов, которые не всосались в тонкой кишке. В зависимости от тяжести заболевания, частота дефекаций может колебаться от 5 до 15 раз в сутки.
Нарушение процессов всасывания (мальабсорбция) со временем приводит к поливитаминной недостаточности. При этом в большей степени нарушается усвоение жирорастворимых витаминов А, Е, D и К. Тяжелое течение заболевания сопровождается нарушением обмена электролитов, ухудшением белкового обмена. Также при энтеропатии может развиваться анемия вследствие недостаточной абсорбции железа в тонкой кишке. Поскольку при этой группе болезней затрудняется поглощение белков и жиров в кишечнике, человек теряет в весе вплоть до развития полного истощения.
Боль при данной патологии выражена в незначительной степени, однако на фоне нарушения проходимости кишки именно она является ведущим клиническим синдромом. Болевые ощущения в основном локализуются в околопупочной области и носят эпизодический характер. Они связаны с периодическим спазмом гладкой мускулатуры тонкого кишечника.
Отдельные формы энтеропатий
Клиническая картина одной из наиболее распространенных врожденных энтеропатий, целиакии, не имеет характерных отличий. Все проявления заболевания возникают при употреблении в пищу злаковых продуктов, в состав которых входит пшеница, овес, рожь и ячмень. Симптомы глютеновой энтеропатии начинают беспокоить в раннем детстве, когда вводится злаковый прикорм. При переходе на диету, не содержащую глютена, происходит обратное развитие клинических проявлений.
Негранулематозная идиопатическая энтеропатия, которая не имеет четкой причины, обычно сопровождается выраженной болью в животе, отсутствием аппетита, снижением веса, повышением температуры, диареей с увеличением количества жиров в кале. Если энтеропатия возникает при артериовенозных аномалиях слизистой оболочки тонкой кишки, то в кале могут выявлять элементы крови.
Экссудативная форма заболевания отличается учащенным обильным стулом с большим количеством слизи. Одной из наиболее тяжелых форм является энтеропатия, которая развивается на фоне Т-клеточной лимфомы. Эта серьезная патология проявляется выраженными отеками на фоне нарушения всасывания белков, которые не корригируются введением белковых компонентов.
Диагностика
Для диагностики энеропатий используются лабораторные и инструментальные методы обследования:
Дифференциальная диагностика
Существенную роль играют специфические диагностические исследования, которые позволяют дифференцировать между собой различные формы энтеропатии. В частности, для постановки диагноза «целиакия» используются нагрузочные пробы с глиадином. При непереносимости глютена данная проба приводит к быстрому повышению уровня глутамина в крови.
Важное значение в дифференциальной диагностике имеет биопсия слизистой оболочки тонкой кишки. Например, при целиакии отмечаются атрофические изменения слизистого слоя. Кроме того, диагностировать глютеновую энтеропатию поможет определение антител к трансглютаминазе. Для выявления аутоиммунной формы заболевания, помимо классических признаков, определяются антитела к энтероцитам. Кроме того, дифференцировать иммунную энтеропатию с целиакией поможет отсутствие ответа на аглютеновую диету.
Лечение энтеропатий
Лечение энтеропатий должно быть направлено в первую очередь на устранение причины, которая привела к возникновению болезни. Этиотропная терапия может быть использована только в том случае, если имеется конкретная причина развития заболевания.
Прогноз и профилактика
Если удается четко установить причину заболевания, то в подавляющем большинстве случаев получается добиться полного выздоровления. При исключении патологического влияния этиологических факторов слизистая кишечника полностью восстанавливает свою структуру и функцию, что сопровождается ремиссией. В зависимости от формы заболевания прогноз может варьироваться от благоприятного при целиакии на фоне правильного лечения до неблагоприятного при энтеропатии, ассоциированной с Т-клеточной лимфомой. Профилактика энтеропатий заключается в использовании рациональной диеты и грамотном лечении заболеваний тонкого кишечника.
Экссудативная энтеропатия у детей
Экссудативная энтеропатия у детей — это клинический синдром, при котором происходит избыточное выделение белков сыворотки крови через желудочно-кишечный тракт. Патология возникает при нарушении лимфооттока, воспалительных и деструктивных поражениях ЖКТ, некоторых кардиологических болезнях. Энтеропатия проявляется расстройствами стула, подкожными отеками, похудением и признаками авитаминозов. Диагностика включает МРТ органов живота, эндоскопию с биопсией энтероцитов, анализ кала на белки (метод ядерной сцинтиграфии, исследование А1-антитрипсина). Лечение состоит из диетической коррекции белкового дефицита и терапии первопричины заболевания.
МКБ-10
Общие сведения
Экссудативная энтеропатия (ЭЭ) — редко встречающееся в педиатрической практике заболевание, частота которого точно не установлена. Впервые об этом нарушении заговорили в 1949 г. Ф. Олбрайт и соавторы, а точная диагностика состояния стала возможна после 1977 г., когда Дж.Р. Кроссли и Р.Б. Эллиот разработали метод определения потерь белка. Патология не имеет патогномоничных симптомов и зачастую протекает под маской других болезней, поэтому для ее выявления врачу требуется большой опыт, хорошо развитое клиническое мышление и проведение комплекса диагностических мер.
Причины
У детей данный вид энтеропатии встречается при врожденной аномалии лимфатических сосудов — первичной кишечной лимфангиэктазии. Этиологическим фактором также служат генетические синдромы: ювенильный полипоз, нарушения гликозилирования и образования гепарансульфат-содержащих протеогликанов. Приобретенные причины экссудативных энтеропатий можно систематизировать в несколько групп:
Патогенез
Механизм развития патологии зависит от ее первопричины. При нарушениях лимфооттока наблюдается застой лимфы в сосудах ЖКТ, в результате чего происходит экссудация белков в просвет кишечника. При лимфангиэктазии в тонкую кишку секретируются не только альбумины, но и другие компоненты: иммуноглобулины, лимфоциты, холестерин и жирорастворимые витамины. При этом вначале иммунитет не страдает, поскольку образование новых иммунных молекул восполняет эти потери.
Любые воспалительные и язвенные повреждения стенки кишечника сопровождаются экссудативной диареей. В патогенезе имеет значение уменьшение числа специфических протеогликанов на базолатеральной поверхности кишечных клеток, накопление провоспалительных цитокинов, повреждающее действие инфекционных агентов. Повышение проницаемости стенки ЖКТ возможно даже при отсутствии воспаления, если между эпителиальными клетками возникают дефекты контактов.
Симптомы
Клиническая картина экссудативной энтеропатии включает диспепсические симптомы и признаки протеинового дефицита. Нарушения всасывания в желудочно-кишечном тракте проявляются в виде стеатореи — у детей появляется обильный зловонный стул с бледно-серым оттенком и маслянистой поверхностью. В кале присутствует большое количество слизи, частицы непереваренной пищи. Типичный признак стеатореи — трудно смываемые следы кала на стенках унитаза.
Частота испражнений повышается до 4-5 раз в сутки у детей старше 1 года и до 10-15 раз у грудничков. Если экссудация протеинов вызвана кишечными заболеваниями, возможно наличие крови в каловых массах. Кроме расстройств стула, ребенок жалуется на боли в животе, тошноту, снижение аппетита. Периодически беспокоят сильное вздутие и урчание в кишечнике, сопровождающееся мучительными коликами.
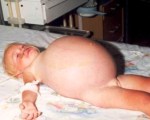
Недостаток сывороточных белков проявляется отеками подкожной клетчатки, которые особенно хорошо видны у детей худощавого телосложения. При сильном белковом дефиците вследствие асцита увеличивается живот. Несмотря на отечный синдром, ребенок начинает терять в весе, поскольку у него нарастает нутритивная недостаточность. Болезненность в костях и суставах, сухость и шелушения кожи, общая слабость и вялость являются симптомами авитаминозов.
Осложнения
Основную опасность для ребенка представляет снижение нутритивного статуса. Вследствие этого возникают задержки роста и физического развития, которые без своевременной коррекции принимают необратимый характер. Дефицит витамина D манифестирует нарушениями минерализации костей и их деформацией, что усугубляет проблему отставания в росте. Нехватка витамина А проявляется нарушениями зрения, а гиповитаминоз Е особо опасен в периоде пубертата.
В начале болезни иммунитет сохраняется на должном уровне, но при длительной нехватке протеинов снижается синтез противоинфекционных факторов. У ребенка формируется вторичный иммунодефицит, возрастает частота ОРВИ и инфекций другой локализации. Снижение иммунитета на фоне мальабсорбции и СИБР чревато попаданием бактерий в полость брюшины и началом гнойного перитонита. Тяжелая гипопротеинемия опасна отеком мозга и отеком легких.
Диагностика
При обследовании ребенка педиатр обращает внимание на особенности питания, узнает о перенесенных заболеваниях и наличии хронических патологий, измеряет антропометрические показатели. Физикальный осмотр включает пальпацию живота, оценку состояния сердечно-сосудистой системы. Диагностика экссудативной энтеропатии сложна и требует использования следующих методов исследования:
Лечение экссудативной энтеропатии у детей
Чтобы корригировать нутритивный статус при экссудативной энтеропатии, ребенку назначается диетическое питание. Из рациона исключают продукты с длинноцепочечными жирными кислотами для уменьшения давления в лимфатических сосудах и воздействия на патогенетические механизмы. Для восстановления уровня белка в крови рекомендовано повышение содержания протеинов в диете до 4 г на кг массы тела. Гиповитаминоз устраняется питанием или витаминными добавками.
Из медикаментозных препаратов применяются кортикостероиды, которые уменьшают воспалительные процессы в кишечной стенке и снижают экссудацию. Для улучшения переваривания и всасывания пищи эффективны ферменты, пробиотики и пребиотики. Если гипопротеинемию не удается корректировать диетой, ребенку проводят инфузии растворов альбумина.
Поскольку ЭЭ всегда развивается вторично, главный пункт в лечении — своевременная диагностика и устранение основного заболевания. С ребенком работает бригада специалистов: детский гастроэнтеролог, аллерголог-иммунолог, ревматолог, другие врачи, которые подбирают комплексную этиопатогенетическую терапию причин экссудативной энтеропатии.
Прогноз и профилактика
Основной прогностический фактор — причина экссудативных потерь протеинов. Если первичное заболевание возможно вылечить, то состояние ребенка быстро нормализуется и уровень белков крови восстанавливается. При хронических рецидивирующих патологиях и врожденных аномалиях прогноз сомнительный. Учитывая разнообразие этиологических факторов и неясный патогенез, меры профилактики болезни не разработаны.
Энтеропатии: новый взгляд на диагностику и лечение болезней тонкой кишки
Энтеропатии (ЭП) – общее название болезней, объединяемых патологическими (воспалительными, геморрагическими эрозивно-язвенными и атрофическими) изменениями тонкой кишки. Современные методы исследования позволяют получить информацию о патоморфологических и функциональных изменениях кишки, однако из-за их сходства при многих нозологических формах дифференциальная диагностика ЭП остается одной из сложных в клинике внутренних болезней.
В таблице 1 представлены наиболее известные ЭП и вызывающие их этиологические факторы. Из таблицы 1 видно, что ЭП могут быть известной и неизвестной этиологии, первичными и вторичными, связанными с патологией других органов и систем, острыми (инфекционными, токсическими, аллергическими) и хроническими.
К ЭП известной этиологии (специфические) относятся глютенчувствительная целиакия (ГЦ), ЭП, вызываемые бактериями, вирусами, грибами и паразитами, лекарствами (нестероидные противовоспалительные препараты – НПВП, антибиотики и др.), пищевыми аллергенами. ЭП могут вызывать физические факторы (радиация, токсины), аномалии развития и приобретенные нарушения проходимости артериовенозных и лимфатических сосудов (мальформации), васкулиты, болезни печени, почек, крови, соединительной ткани, эндокринной и иммунной системы. Правильно установленный нозологический диагноз при ЭП известной этиологии позволяет добиться выздоровления с восстановлением структуры слизистой оболочки тонкой кишки (СОТК) или глубокой клинико-морфологической ремиссии при условии исключения влияния этиологического фактора и выполнения оптимальной программы лечения [1].
Наиболее тяжелыми и прогностически сомнительными являются ЭП неизвестной этиологии, то есть неспецифические. К ним относятся целиакия, нечувствительная к глютену (рефрактерная), гипогаммаглобулинемическая спру (ГГГС), коллагеновая спру, аутоиммунная ЭП с образованием антител к энтероцитам, гранулематозный энтерит (болезнь Крона), идиопатический негранулематозный еюноилеит, эозинофильный гастроэнтерит, ЭП, развивающаяся при реакции «трансплантат против хозяина». Хотя причины этих ЭП остаются неизвестными, механизмы понимания патологического процесса находятся на молекулярном уровне, а биологическая терапия настолько эффективна в подавлении воспаления, что конечной точкой ремиссии может быть достижение полного восстановления структуры и функции тонкой кишки.
Патоморфология ЭП не имеет строго патогномоничных нозологических критериев. Тем не менее патогистологическая картина ГЦ, болезни Уиппла, ГГГС, коллагеновой спру, гранулематозного илеита Крона и некоторых других позволяет установить точный нозологический диагноз.
Для ГЦ характерно снижение высоты ворсинок (атрофия), углубление (гиперплазия) крипт, инфильтрация лимфоцитами и плазмоцитами собственной пластинки и эпителиоцитов (межэпителиальные лимфоциты – МЭЛ). Исключение из пищевого рациона растительного белка глютена, содержащегося в пшенице, ржи и ячмене, приводит к постепенному восстановлению СОТК. Если лечение не оказывает заметного влияния на СОТК, то речь должна идти о рефрактерной форме целиакии. Различают 2 типа рефрактерной целиакии. При 1-м типе СОТК инфильтрирована нормальным лимфоплазмоцитарным фенотипом. При 2-м типе МЭЛ представлены аберрантным клоном лимфоцитов, предрасположенных к развитию Т-клеточной лимфомы.
При ГГГС структура СОТК сходна с таковой при ГЦ, но отличается почти полным отсутствием в инфильтрате плазматических клеток, продуцирующих основные классы иммуноглобулинов (Ig). При коллагеновой спру СОТК также атрофирована, а под базальной мембраной энтероцитов образуется слой коллагена, существенно нарушающий пищеварительно-транспортную функцию тонкой кишки (рис. 1). Лечение больных ГГГС и коллагеновой спру аглютеновой диетой (АГД) не оказывает влияния на СОТК.
К редким формам относится аутоиммунная ЭП. Для нее характерны хроническая диарея, тяжелый синдром нарушенного всасывания, сходная с целиакией атрофия ворсинок и гиперплазия крипт, лимфоплазмоцитарная инфильтрация собственной пластинки СОТК с повышенным количеством МЭЛ. У некоторых снижен IgА. Патогенез аутоиммунной ЭП связан с появлением антител к собственным энтероцитам. Больные не отвечают на лечение АГД, течение болезни отличается плохим прогнозом.
При болезни Уиппла в макрофагах собственной пластинки СОТК поселяются бактерии Уиппла (Tropheryma whippelii). Скопления макрофагов, заполненных PAS-положительными гранулами бактериального происхождения, служат диагностическими маркерами болезни Уиппла (рис. 2). Их находят также в лимфатических сосудах тонкой кишки и других органов у пациентов с нарушенной функцией макрофагов, не отвечающих на присутствие бактерий выработкой специфических антител. В результате развивается синдром экссудативной ЭП, поражение суставов, нервной системы и других органов.
Болезнь Крона (БК) характеризуется развитием воспаления стенки кишки с формированием гранулем в подслизистом слое, содержащих гигантские эпителиоидные клетки Пирогова – Лангханса. Уже на ранней стадии появляются поверхностные язвы (афты) (рис. 3), которые не являются специфическими и отражают лишь тяжесть воспалительной реакции и ее длительность. В редких случаях язвенный еюнит (илеит) развивается без гранулематозного воспаления и классифицируется как негранулематозный еюноилеит неизвестной этиологии.
Экссудативная ЭП может быть первичной (вследствие аномалии развития) и вторичной. Вторичный синдром экссудативной ЭП развивается в результате механической или функциональной блокады лимфатического аппарата кишечника воспалительной или опухолевой природы. Он может сопутствовать болезни Уиппла, васкулитам, правожелудочковой сердечной недостаточности. Гистологическими признаками экссудативной ЭП служат ворсинки, заполненные лимфой. В собственной пластинке СОТК видны расширенные лимфатические сосуды, приобретающие вид лимфатических «озер» (рис. 4).
Клиническая картина ЭП характеризуется хронической диареей, симптомами мальабсорбции и аутоиммунными нарушениями. Болевой синдром отсутствует или незначителен, но при нарушении проходимости тонкой кишки может стать ведущим в клинической картине.
При инфекционной ЭП диарея водянистая, является следствием избыточной секреции воды и электролитов в просвет кишки. Основные активаторы секреции – бактериальные токсины, вирусы, лекарства и биологически активные вещества.
В механизме диареи при мальабсорбции ведущую роль играет повышение осмотического давления неабсорбированного химуса, вызывающего задержку воды в просвете кишки. Стул становится обильным с большим количеством продуктов гидролитического расщепления нутриентов. При исследовании крови часто выявляется микроцитарная, или В12-дефицитная, анемия, вызванная снижением всасывания железа, витамина В12 и фолиевой кислоты. Уменьшение в сыворотке крови ионов калия, кальция, магния и хлора, белка и холестерина указывает на их плохое всасывание в тонкой кишке.
В патогенезе диареи при БК, инфекционных и других энтеропатий с повреждением СОТК, а также вследствие гамартий (синдромы Пейтца – Егерса и Кронкайта – Канада) преобладает экссудация воды, электролитов и белка в просвет кишки. Стул жидкий, часто с кровью и гноем. Характерны боли в животе, лихорадка, анорексия, похудение и отеки. В анализах крови наблюдается лейкоцитоз, повышенная скорость оседания эритроцитов, повышение С-реактивного белка, фекального кальпротектина, гипоальбуминемия и гипопротеинемия.
БК характеризуется прогрессирующим течением. Различают три фенотипа или формы БК – воспалительную (люминальную), cтенозирующую и пенетрирующую (экстралюминальную), осложняющуюся межкишечными и иными свищами, абсцессами и инфильтратами в брюшной полости. В отличие от БК негранулематозный неспецифический еюноилеит не имеет склонности к стенозам и экстралюминальным осложнениям.
Основным проявлением ЭП, ассоциированной с артериовенозными мальформациями кровеносных и лимфатических сосудов, могут быть рецидивирующие кровотечения, источником которых служат повреждения (изъязвления) артериовенозных ангиэктазий. При лимфангиэктазиях возникает избыточная потеря белка в просвет кишки.
Диагноз и дифференциальная диагностика
Нозологическая диагностика болезней тонкой кишки улучшается по мере усовершенствования иммунологических, рентгенологических и особенно эндоскопических методов [2]. На рисунке 5 показаны возможности каждого из них в распознавании ЭП.
Основное значение для установления нозологического диагноза целиакии, коллагеновой и тропической спру, болезни Уиппла, ГГГС, эозинофильного гастроэнтерита имеет гистологическое исследование биоптатов СОТК, полученных из дистального отдела двенадцатиперстной кишки. Тем не менее надо иметь в виду, что сходная с целиакией атрофия ворсинок слизистой оболочки вблизи луковицы двенадцатиперстной кишки развивается у ряда больных кислотозависимыми заболеваниями вследствие влияния на нее пептического фактора. Диагностике ГЦ в этих случаях помогают иммунологические исследования на антитела к тканевой трансглутаминазе (АТтТГ) и антитела к диамидированному пептиду глиадина (АТДПГ), которые отсутствуют при пептических дуоденитах [3].
Атрофию ворсинок, напоминающую таковую при ГЦ, можно наблюдать и у пациентов с общим вариабельным иммунодефицитом, особенно при наличии симптомов мальабсорбции. В этом случае речь идет о ГГГС [1]. Для эозинофильного гастроэнтерита характерна эозинофильная инфильтрация стенки кишки, не имеющая отношения к аллергии пищевого или паразитарного происхождения.
Правильный диагноз в этих случаях устанавливают при гистохимическом исследовании биоптатов, полученных из патологически измененной СОТК, а также с помощью ультразвукового исследования (УЗИ), компьютерной (КТ) или магнитно-резонансной томографии (МРТ).
Ответ на АГД является тестом на целиакию, хотя некоторое клиническое улучшение может наблюдаться и при ЭП, не связанной с глютеном [5]. Поэтому данный симптом следует оценивать с осторожностью как диагностический признак. У больных с незначительным повышением АТтТГ IgА и АТДПГ рекомендуется проводить тест на HLA-DQ2/DQ8. Диагностика целиакии с использованием генотипов HLA-DQ2 и HLA-DQ8 основана на тесной связи между ГЦ и определенными типами HLA: более чем у 95% больных определяются DQ2, а почти у всех остальных – DQ8.
К ЭП, не связанной с глютеном, относится аутоиммунная форма. Диагноз аутоиммунной ЭП правомочен, если пациент с клинической картиной целиакии и аутоиммунными манифестациями не отвечает на АГД. Диагностике помогают первоначальные результаты серологических тестов на ГЦ, определение антител к энтероцитам или бокаловидным клеткам, HLA-DQ2/DQ8-тестирование, повторная биопсия и сравнение гистологической картины с ранее выполненной биопсией СОТК.
Современные методы хотя и расширили возможности распознавания ЭП, но не решили многих проблем дифференциальной диагностики. Это связано с тем, что патоморфологические признаки ЭП (изменения слизистой оболочки, формы и высоты складок, просвета кишки, ее тонуса) не являются специфическими при ЭП у больных с НПВП-ассоциированной энтеропатией и другими заболеваниями тонкой кишки.
Эндоскопический, рентгенологический и ультразвуковой методы при визуализации пораженного участка кишки дополняют друг друга. Глубокая эндоскопия тонкой кишки и капсульная эндоскопия обладают высокой чувствительностью и специфичностью к обнаружению воспалительных проявлений СОТК. Более глубокие слои кишечной стенки доступны оценке при изображении кишки в поперечном сечении, позволяющем обнаружить стриктуры, свищи и абсцессы. Поэтому при БК одинаково важное значение имеет как осмотр поверхности кишки, позволяющий увидеть афты, изменение рельефа и диаметра просвета кишки, доступные эндоскопическому методу, так и оценка толщины всей стенки кишки с помощью УЗИ, КТ и МРТ, особенно с использованием контрастных растворов, введенных внутривенно.
Особые трудности представляет распознавание ЭП, причиной которой служит випома, гастринома, карциноид и другие нейроэндокринные опухоли (НЭО). Основным клиническим проявлением ЭП при НЭО является хроническая диарея, преимущественно водянистая, резистентная к терапии. При диффузном типе распределения нейроэндокринных опухолевых клеток в СОТК постановка диагноза особенно трудна и основана на выявлении в крови повышенной концентрации соответствующего гастроинтестинального гормона (гастрина, вазоактивного интестинального пептида, серотонина и др.), а также хромогранина А – высокочувствительного и специфичного маркера НЭО [6] с последующей верификацией самой опухоли в кишечнике или поджелудочной железе.
На рисунке 6 показан алгоритм дифференциальной диагностики ЭП, созданный нами, на основе предложенного K. Pallav и соавт. алгоритма диагностики нецелиакальной ЭП [7]. Больному с патогистологическими признаками ЭП проводят серологические тесты на целиакию. Повышенный уровень АТтТГ и/или АТДПГ позволяет установить ГЦ и назначить лечение с обязательным соблюдением АГД. Положительный ответ на лечение, наступающий обычно уже через 10–15 дней, подтверждает диагноз ГЦ, и больному пожизненно назначается АГД. При отсутствии улучшения необходимо провести генетическое исследование на HLA-DQ2 и HLA-DQ8. Положительные результаты типирования у пациента с атрофией ворсинок и гиперплазией крипт дают основание для диагностики целиакии, не связанной с глютеном, то есть рефрактерной спру. У больного, не имеющего гаплотипов DQ2 или DQ8, необходимо оценить иммунный статус. При снижении IgA нужно провести тест на антитела к ДПГ и при положительных значениях антител можно подтвердить у больного ГЦ, а при их отсутствии – ЭП, не связанную с глютеном. Окончательный диагноз устанавливают после повторной оценки гистологических препаратов с целью исключения коллагеновой спру, тропической спру, болезни Уиппла, эозинофильного гастроэнтерита и аутоиммунной ЭП. Обследование больных рефрактерной целиакией следует проводить, памятуя о высоком риске развития у них Т-клеточной лимфомы, ассоциированной с ЭП.
При выявлении у больного с атрофией ворсинок СОТК общего вариабельного иммунодефицита и нормальном уровне альбуминов правомерен диагноз ГГГС.
Дифференциальную диагностику со специфическими ЭП инфекционной этиологии осуществляют с применением бактериологических исследований. ЭП, связанную с дефицитом лактазы или других ферментов тонкой кишки, верифицируют с помощью биохимических тестов с определением их в биоптатах СОТК.
Терапия больных ЭП может быть этиотропной, патогенетической и симптоматической. В таблице 2 приведены принципы терапии.
Этиотропная терапия. В основе этиотропной терапии ГЦ лежит строгая пожизненная приверженность АГД. Соблюдение этого принципа наряду с безусловно положительными влияниями несет в себе много проблем. Они связаны с ограничениями социальных и бытовых условий жизни больного. Исключение из рациона пшеницы, ржи и ячменя существенно сужает качественный состав пищевого рациона, затрудняет его обеспечение, тем более что многие из продуктов (мясные, кисломолочные и др.) содержат глютен, делает его более дорогим. В большинстве развитых стран налажена маркировка продуктов на содержание глютена. Больные получают денежные дотации. Специалисты в области пищевой промышленности работают над созданием генетически модифицированных сортов пшеницы, лишенных иммуногенных антигенных детерминант. Фармацевтическая промышленность приступила к созданию ферментных препаратов, способных расщеплять глиадин: проходит клинические испытания пролилэндопептидаза. Исследуются агенты типа октапептида АТ-1001, которые блокируют рецепторы зонулина и тем самым уменьшают проницаемость межэпителиальных соединений и приток глютена в собственную пластинку СОТК.
Больным аллергическим гастроэнтеритом из рациона исключают пищевые аллергены. При болезни Уиппла применяют диету, бедную длинноцепочечными и обогащенную среднецепочечными триглицеридами, которые содержатся в продуктах энтерального питания (нутризон, портаген, энтритион, изокал и др.). Пациентам с нарушением всасывания назначают диету с повышенным количеством белка (до 130 г/сут). Основным методом устранения гипопротеинемии является длительное внутривенное введение белоксодержащих растворов, в первую очередь альбумина и гамма-глобулина. Всем больным показаны препараты калия, кальция, железа. Дважды в год назначают курсы лечения витаминами.
Пациентам с ЭП инфекционной этиологии назначают антибиотики.
При болезни Уиппла и ЭП, ассоциированной с лимфангиэктазиями, лечение начинают с введения цефтриаксона по 1 г в/в или в/м каждые 24 часа в течение 2 недель. Затем назначают антибиотики, которые способны проникать через гематоэнцефалический барьер. К таким препаратам относится сочетание триметоприма по 160 мг/сут с сульфаметоксазолом по 1,6 г/сут внутрь. Лечение обычно продолжается от 1 до 2 лет и прекращается только после исчезновения РАS-положительных макрофагов в СОТК.
Пациентам с тропической спру и инфекционными гастроэнтеритами обычно назначают антибиотики из группы хинолонов II поколения (ципрофлоксацин) и нитрофураны (фуразолидон и др.).
К препаратам с этиотропным механизмом также относятся антибиотики местного действия и кишечные антисептики, предотвращающие избыточный рост микрофлоры в тонкой кишке. В последние годы предпочтение отдается более современному и безопасному рифаксимину.
Рифаксимин-альфа (Альфа Нормикс, Alfa Wassermann (Италия)) имеет широкий спектр антибактериальной активности, воздействуя на большинство грамположительных и грамотрицательных как аэробных, так и анаэробных бактерий.
Рифаксимин-альфа демонстрирует практически полное отсутствие всасывания в желудочно-кишечном тракте. Это было убедительно доказано в экспериментальных исследованиях у животных, а затем в клинических исследованиях у здоровых добровольцев и пациентов с заболеваниями кишечника. Всасыванию рифаксимина-альфа препятствует наличие в его молекуле пиридоимидазо-группы, электрический заряд и ароматическое кольцо которой препятствуют прохождению через эпителий кишечника. Установлено, что при пероральном приеме рифаксимина-альфа натощак в крови обнаруживается не более 0,4% от принятой дозы.
Минимальное всасывание действующего вещества в плазму крови снижает риск возникновения системных побочных эффектов, внекишечных лекарственных взаимодействий с другими препаратами, а у пациентов с заболеваниями печени и почек нет необходимости в коррекции дозы.
В последние десятилетия эффективность рифаксимина-альфа активно изучалась в зарубежных и российских плацебоконтролируемых исследованиях.
Рекомендуется следующая схема приема препарата: 800–1200 мг/сут (2 таблетки по 200 мг 2–3 раза в день) в течение 7 дней, ежемесячно с проведением повторных курсов через 20–40 дней по мере необходимости.
Патогенетическая терапия. В лечении ЭП неизвестной этиологии (БК, аутоиммунная ЭП, коллагеновая спру, рефрактерная спру, ГГГС ) применяют системные и топические глюкокортикостероиды (будесонид), препараты 5-аминосалициловой кислоты (Пентаса), иммунодепрессанты (азатиоприн и др.), ингибиторы ФНО-альфа (инфликсимаб, адалимумаб). В ЦНИИГ нами успешно применяется трансплантация аллогенных мезенхимальных стволовых стромальных клеток [8]. В случае осложнения рефрактерной целиакии развитием Т-клеточной лимфомы можно добиться полной ремиссии заболевания с помощью высокодозной полихимиотерапии и трансплантации аутологичных стволовых клеток [9].
В механизмах развития любой ЭП одно из ведущих мест занимает нарушение кишечного пищеварения и всасывания и, как следствие, предрасположенность к избыточному росту микробной флоры в тонкой кишке. Поэтому при обострениях любой ЭП показана антибактериальная терапия (рифаксимин-альфа или кишечные антисептики).
С целью восстановления структуры и пищеварительно-транспортной функции СОТК применяются энтеропротекторы.
Энтеропротектор Энтеросан зарегистрирован в России в 1998 г. как оригинальное лекарственное средство, содержащее природную смесь полимеризированного секрета мышечного отдела желудка птиц. Он содержит гликопротеины, полисахариды, гликозаминогликаны, сиаломуцины, регуляторные пептиды, желчные и нуклеиновые кислоты, протеолитические ферменты. Каждый из компонентов влияет на морфологию и функцию эпителиоцитов СОТК. Энтеросан способен повышать барьерную функцию кишечника, улучшать активность и синтез пищеварительных ферментов тонкой кишки. Препарат способствует улучшению всасывания, восстановлению нормальной кишечной микрофлоры, устранению избыточного роста микробной флоры в тонкой кишке. Энтеросан назначают по 1-й капсуле (0,3 г) 3 раза в день за 15 минут до еды. Курс лечения – 3 недели [10].
К препаратам с патогенетическим механизмом, направленным на улучшение структуры и функции кишечника, относятся также пробиотики. Вырабатываемые симбионтной микрофлорой короткоцепочечные жирные кислоты оказывают разностороннее действие на клеточную дифференциацию, пролиферацию и апоптоз эпителиоцитов кишечника, индукцию продукции антимикробных пептидов, нейротрансмиттеров, гормонов, подвижность кишечника, иммунитет, межклеточные взаимоотношения и т.д. [11]. Поэтому пробиотики (Бифиформ, Пробифор и др.), пребиотики (Инулин, лактулоза, Лизоцим и др.) или их комбинации (Бактистатин) находят все большее распространение в терапии болезней кишечника. Длительность приема 2–3 недели.
Симптоматическая терапия. Симптоматические средства используются при лечении всех ЭП. Для улучшения кишечного пищеварения показаны ферментные препараты, улучшающие кишечное пищеварение (Креон, Лактаза), энтеросорбенты (Смекта, лигнин гидролизный), регуляторы моторики кишечника (тримебутин, лоперамид), регуляторы кишечной секреции (соматостатин).