Фактор яманаки что это
Клеточное старение удалось обратить вспять
На протяжении всей своей истории человечество искало секрет вечной молодости. Но лишь ученым из Стэнфордского университета, возможно, удалось подобраться на шаг ближе к желаемому. Недавно команда исследователей сообщила, что им удалось омолодить человеческие клетки с помощью механизма, применяемого при создании стволовых клеток. Результаты работы показали, что метод, призванный обратить вспять ошибки копирования ДНК и вернуть клеткам молодость, действительно устраняет признаки старения и восстанавливает энергию клеток. Ученые надеются, что в будущем разработанный ими метод поможет в лечении заболеваний, вызванных старением клеток тканей. Более того, полученные результаты – это важный и значительный шаг к победе над старением.
Клеткам можно вернуть утраченную молодость, выяснили ученые
Что такое факторы Яманаки?
Вернуть молодость клеткам оказалось возможно с помощью факторов Яманаки – белков, которые обычно превращают клетки в стволовые. Более того, как пишут авторы исследования, факторы Яманаки играют важную роль в создании эмбриональных клеток.
Эмбриональные клетки – это клетки, полученные из оплодотворенной яйцеклетки, способные развиться в любой из специализированных типов клеток организма.
Целью процедуры омоложения клеток была ликвидация негативных факторов, которые проявляются по мере старения организма. В ходе работы, опубликованной в журнале Nature Communications, использование факторов Яманаки позволило ученым обратить вспять ослабление клеточных систем, которое происходит по мере старения. Напомним, что сегодня ученые всего мира работают над созданием эффективного способа борьбы со старением. Подробнее о том, каких результатов исследователям уже удалось добиться, читайте в нашем материале.
Старение – процесс, которого всем нам хотелось бы избежать
Стволовые клетки – это клетки-предшественники всех остальных клеток организма. Стволовые клетки обладают способностью превращаться в другие клетки и поддерживают свою численность с помощью деления.
Как пишет The New York Times, в 2006 году Синья Яманаки, исследователь стволовых клеток из университета Киото (Япония), поразил биологов, продемонстрировав, что судьбу клетки можно изменить с помощью набора из четырех транскрипционных факторов – агентов, активирующих гены, которые определил ученый. Клетка, дозированная факторами Яманаки теряет свою идентичность и возвращается в эмбриональное состояние. Ошибки в геноме, которые накапливаются по мере старения клеток, также теряются в процессе омоложения. Работа доктора Яманаки была отмечена Нобелевской премией по медицине в 2012 году.
Еще больше увлекательных статей о том, будем ли мы жить больше ста лет, читайте на нашем канале в Яндекс.Дзен.
Как омолодить клетки?
В 2016 году Хуан Карлос Изписуа Бельмонте из Института биологических исследований Солка в Сан-Диего обнаружил, что два эффекта факторов Яманаки – стирание идентичности клеток и обращение вспять старения – могут быть разделены. Причем более низкая доза факторов Яманаки обеспечивает только изменение возраста клетки. Однако эти результаты были получены на клетках лабораторных мышей, а не людей.
Возможно, в будущем люди будут дольше оставаться молодыми и здоровыми
В новой работе ученые из Стэнфордского университета описали возможный способ доставки факторов Яманаки в клетки, взятые у пациентов. Авторы статьи утверждают, что при дозировании клеток факторами Яманаки в течение короткого периода времени, клетки сохраняют свою идентичность и возвращаются в молодое состояние. В ходе работы ученые извлекли старые хрящевые клетки пациентов с остеоартрозом и обнаружили, что после низкой дозы факторов Яманаки клетки больше не секретируют воспалительные факторы, которые провоцируют заболевание.
Секреция – процесс выделения химических элементов из клетки.
Исследователи также обнаружили, что человеческие мышечные стволовые клетки, которые повреждаются при мышечной адинамии – резкий упадок сил и мышечная слабость, сопровождается значительным уменьшением или прекращением двигательной активности – могут быть восстановлены. Таким образом, это открытие уже сегодня может позволить разрабатывать терапевтические средства для лечения остеоартрита и других заболеваний.
Вода студеная, вареная и кипящее молоко, или Еще раз об омоложении
Автор
Редакторы
Пожалуй, каждый, кто находил у себя первую морщинку или первый седой волос, нет-нет да и задумывался о том, как было бы здорово, если бы ученые придумали лекарство от старости. Борьба со старением — дело нелегкое, поэтому любые успехи в этой области, достигнутые на «братьях наших меньших», это уже повод для большой радости. Недавно биологи нашли способ омолодить мышцы мух дрозофил, избавив их от митохондрий, несущих вредоносные делеции в своих молекулах ДНК. Другая группа ученых продлила жизнь мышам методом частичного перепрограммирования их эпигенома. А там и до «молодильных яблок» для нас, Homo sapiens, недалеко.
12 биологических новостей в картинках
Вообще, мы серьезные люди. Гранит науки хрустит на наших зубах. Мы освещаем такие суровые, такие сложные закоулки биологического знания, до которых не дотянулись фонари других научно-популярных сайтов. Но иногда нам так хочется подурачиться. И рассказать о науке веселым языком, показать ее под другим углом. Нарисовать забавных картинок, написать легкий и смешной текст. Поэтому мы и открыли новую рубрику — «12 биологических новостей в картинках».
Интеллектуальный партнер этих иллюстрированных рассказов — АО РВК.
Современные представления ученых о старении предполагают, что это не просто механический износ всех систем, а процесс, управляемый некими «генетическими часами», которые велят нашему телу и разуму неумолимо угасать.
Говорить о бессмертии пока бесконечно рано, но если как следует покопаться в механизме этих самых «генетических часов», то, оказывается, процесс старения всё же можно обратить. Достаточно пристальное внимание этой теме «биомолекула» уделила в спецпроекте по старению и долголетию (знакомство с ним можно начать с вводной статьи [1]).
Старение, кроме приближения неизбежного финала, сопровождается массой сопутствующих болезней и состояний. В частности, многие из старческих болезней могут вызываться накоплением в клетках, наряду с нормальными митохондриями, митохондрий с различными поломками в ДНК — мутациями. Явление, когда в одних и тех же клетках находятся митохондрии с «добрыми» и «злыми» генотипами, называется гетероплазмией. Гетероплазмия может вносить свой коварный вклад в развитие метаболических нарушений, нейродегенеративных заболеваний, рака, болезней сердца и саркопении (возрастной атрофии скелетных мышц), которые так или иначе связаны со старением организма.
Многие важные биологические механизмы сначала открывают и изучают у практически на-всё-готовых мух-дрозофил. В норме гетероплазмия у дрозофил, конечно, встречается тут и там, но чтобы превратить это явление в модель для изучения, понадобились средства генетической инженерии.
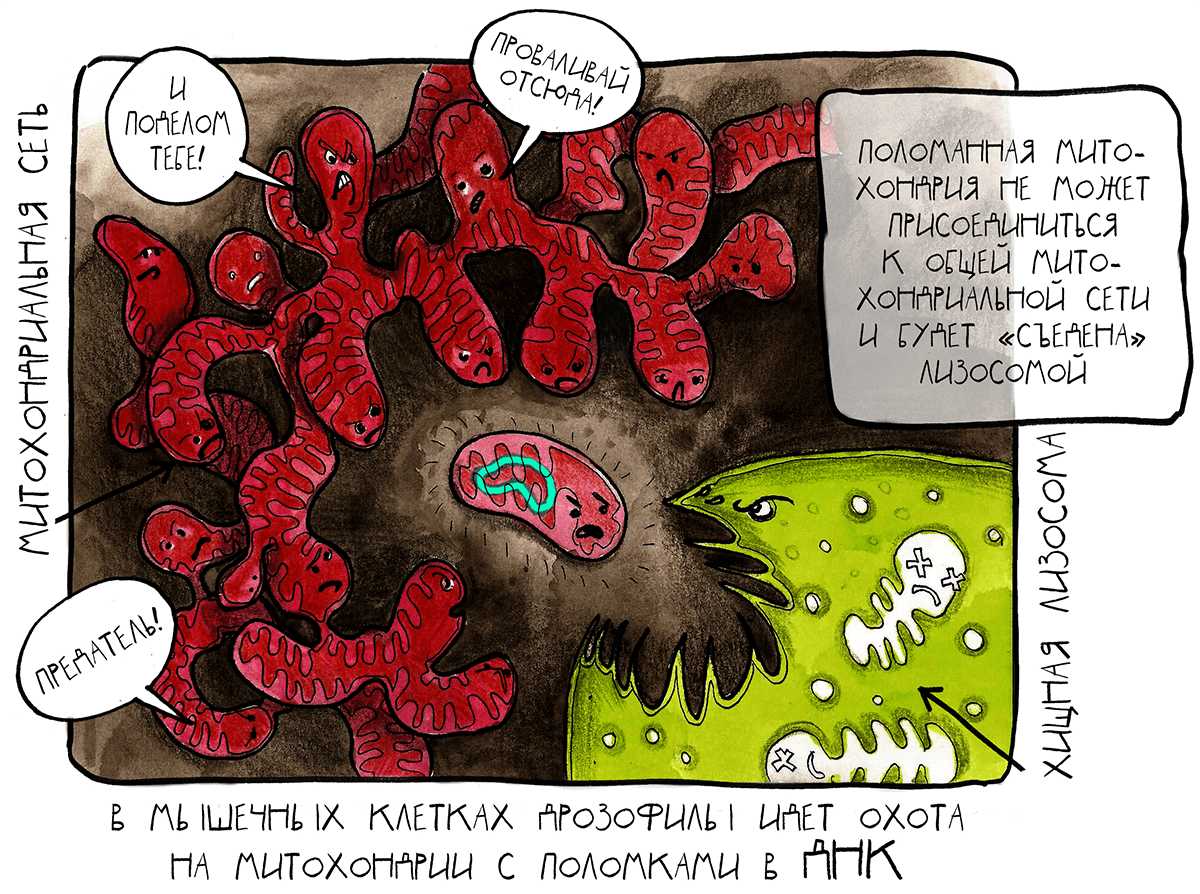
Группа ученых из Калифорнии создала систему [2], в которой гены специально натасканных на митохондрии ферментов — рестриктазы AflIII (mitoAflIII) и ДНК-лигазы Т4 (mitoT4lig) — экспрессировались под контролем промотора, работающего только в одной из мышц — той, что обеспечивает движение крыльев и полет дрозофилы. Эта не жизненно важная, характерная только для взрослых особей, энергоемкая, состоящая из постмитотических (неделящихся) клеток и содержащая огромное количество митохондрий ткань идеально подходит для наблюдения и оценки эффектов повышенного уровня гетероплазмии во взрослом организме. У молодых имаго в митохондриях этой мышцы рестриктаза mitoAflIII разрезала митохондриальную ДНК в двух местах. При этом вырезанный фрагмент с несколькими важными генами терялся, а лигаза mitoT4lig сшивала оставшиеся концы ДНК. Так образовывалась делеция. Митохондрии с такими делециями накапливались в мышце в большом количестве (
76%), однако это не мешало мышце функционировать.
Чтобы увидеть рисунок в полном размере, нажмите на него.
В норме митохондрии с поломками уничтожаются клеткой при помощи механизма, который носит название митофагия (частный случай аутофагии ). Этот механизм управляется белками PINK1 (PTEN-induced putative kinase 1) и Parkin (нарушение работы этого белка у человека приводит к развитию болезни Паркинсона) и функционирует так: мембрана поломанной митохондрии деполяризуется, разрушаются мембранные белки митофузины, и митохондрия теряет возможность присоединяться ко всеобщей митохондриальной сети. В конце концов эту одинокую митохондрию уничтожают лизосомы.
Смысл и примеры «самоедства» на разных уровнях организации живой материи и в разных доменах живой природы обсуждаются в статье «Аутофагия, протофагия и остальные» [3]. Аутофагия во всех ее проявлениях оказалась настолько важным и захватывающим процессом, что в прошлом году снискала особое расположение Нобелевского комитета: «Нобелевская премия по медицине и физиологии 2016: за самоедство» [4]. — Ред.
Процесс митофагии в мышцах идет не слишком бодро, поэтому-то со временем уровень гетероплазмии всё же растет, и мышца стареет. Но, как выяснили калифорнийские ученые, омоложение такой мышцы можно стимулировать несколькими способами:
Эти открытия на дрозофиле послужат отправной точкой для генетических и химических скринингов. Эти скрининги помогут выявить молекулы, способные очистить ткани от поломанных митохондрий и потому стать долгожданным лекарством от старости для нас.
Всего через месяц после публикации статьи о мухах с омолодившимися мышцами другие калифорнийские биологи порадовали мир новостью об омоложении мышей [5], которые, по сравнению с мухами, уже почти что люди.
Чтобы увидеть рисунок в полном размере, нажмите на него.
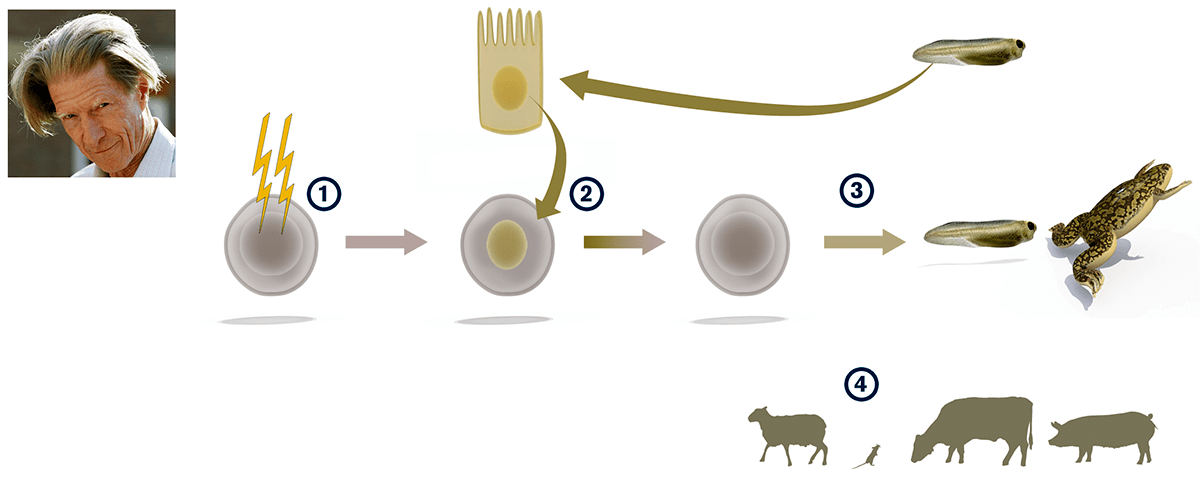
В качестве модели для этого эксперимента выбрали мышей с мутацией, приводящей к прогерии — преждевременному старению. В основе лечения таких мышей-старичков лежала уже весьма известная и изученная технология получения индуцированных плюрипотентных стволовых клеток (ИПСК). Ее суть в том, что из дифференцированных клеток путем генетического перепрограммирования получают стволовые клетки, способные стать любым другим типом клеток. Такое перепрограммирование достигается, когда в клетках с предопределенной судьбой в течение нескольких недель индуцируют экспрессию всего четырех генов: Oct4, Sox2, Klf4 и c-Myc — так называемых факторов Яманаки (Yamanaka factors) [6–8]. В результате изменяется эпигеном этих клеток — «штатное расписание» работы всех генов [9]. «Генетические часы» такой клетки как будто возвращаются в 00 часов 00 минут.
Но в случае борьбы со старением такое обнуление на уровне всего организма было бы фатальным: клетки кожи, например, «забыли» бы, кто они. Поэтому ученые индуцировали экспрессию факторов Яманаки у мышей, больных прогерией, всего лишь в течение нескольких дней. В результате многие органы существенно омолодились. Под микроскопом ткани кожи, селезенки, почек и желудка просто излучали молодость и здоровье. Кроме того, у грызунов улучшилась работа сердечно-сосудистой системы, которая с возрастом обычно изнашивается первой. Процесс накопления повреждений ДНК, сопутствующий прогерии, замедлился, и мыши-старички стали жить целых 24 недели вместо положенных судьбой 18.
Эта работа доказала, что борясь с возрастными изменениями эпигенетической информации, можно не только увеличить продолжительность жизни, но и системно оздоровить многие органы.
К большому сожалению, использованные в этом исследовании технологии нельзя тут же применить к людям, и до клинических испытаний потенциальных лекарств от старости, по словам ученых, должно пройти не меньше 10 лет. Тем не менее мысль, что нам удастся на своем веку отведать первый урожай «молодильных яблок», радует бесконечно.
Найден новый «фактор Яманаки» для создания стволовых клеток
Найден новый белок, который участвует в перепрограммировании плюрипотентных стволовых клеток. Это первое открытие с 2007 года, когда японский ученый Синъя Яманака идентифицировал четыре белка, необходимых для изготовления стволовых клеток.
«Факторы» Яманаки или четыре белка, которые ученый открыл в 2007 году для перепрограммирования плюрипотентных стволовых клеток, больше не являются уникальными в своем роде. Ученые из Стэнфорда идентифицировали новый белок, который может выполнять аналогичные функции.
Команда определила, что белок NKX3-1 может заменить один из четырех ранее открытых факторов Яманаки и с успехом использоваться для производства индуцированных плюрипотентных стволовых клеток или клеток iPS.
Ученые создали уникальную лабораторную модель для перепрограммирования клеток, которая синхронизирует самые ранние этапы процесса. Ранняя стадия перепрограммирования — наиболее сложный этап, поскольку только одна из тысячи клеток успешно трансформируется, пишет сайт Стэнфордского университета.
«Почти весь ранний этап перепрограммирования остается загадкой для ученых. Клетки трансформируются по своему собственному желанию и весьма непредсказуемому графику», — говорит исследователь Хелен Блау.
В эксперименте исследователи использовали фибробласты человека и эмбриональные стволовые клетки мышей. Используя гетерокарионную модель, они обнаружили, что белок NKX3-1 экспрессируется в течение примерно двух часов после начала перепрограммирования, но быстро рассеивается. Если процесс блокируется, то факторы Яманаки более не способны перепрограммировать человеческие фибробласты, указывая на важную роль NKX3-1 в превращении взрослых клеток в стволовые. Ученые также обнаружили, что добавленный NKX3-1 может заменить белок Oct4 (один из четырех факторов) для перепрограммирования клеток без потери эффективности.
Кроме того, экспрессия NKX3-1 необходима для запуска экспрессии белка Oct4 и способствует другим генетическим изменениям, которые облегчают перепрограммирование.
«Перепрограммирование полностью меняет судьбу клетки. Наша цель — понять все механизмы и пути, которые способствуют этому процессу», — заключает Блау.
Перепрограммирование iPS открыло в 2007 году невероятные возможности перед медициной. Тогда были открыты четыре фактора-белка: Oct4, Sox2, KLF4 и c-Myc. Сегодня технология способствует выращиваю новых органов, тестированию лекарств и новых методов терапии. Идентификация нового белка поможет иначе взглянуть на логику перепрограммирования и найти способы производства новых плюрипотентных стволовых клеток в лабораториях.
Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки
Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки
Колонии человеческих индуцированных плюрипотентных стволовых клеток (ИПСК) человека, полученные из клеток кожи
William Collins, Gladstone Institutes
Автор
Редакторы
Эмбриологи в первой половине XX века считали, что клетка — она как человек: в «детстве» (недифференцированном состоянии) все дороги открыты, а «взрослой» специализированной клетке обратного пути уже нет. В 2012 году Нобелевская премия по физиологии и медицине вручена за опровержение этой догмы: Джон Гардон и Шинья Яманака награждены «за открытие факта, что зрелые клетки могут быть „перепрограммированы“ обратно в плюрипотентное состояние».
Нобелевскую премию по физиологии и медицине в 2012 году получили Джон Гардон (John B. Gurdon) и Шинья Яманака (Shinya Yamanaka) «за открытие факта, что зрелые клетки могут быть „перепрограммированы“ обратно в плюрипотентное состояние». Их открытие продолжает ряд исследований, опровергающих догмы: ранее считалось, что процесс клеточной дифференциации — это «билет в один конец», и клетки, обретшие специализацию, уже никогда не могут вернуться в первичное состояние, когда все пути к дифференциации в различные клеточные линии еще открыты. (Такое состояние называют плюрипотентным.) В 1962 году британский биолог развития Гардон заложил первый камень в фундамент нового здания, показав, что пересадка ядра эпителиальной клетки взрослой лягушки в икринку, лишенную клеточного ядра, успешно дает начало нормальному головастику, в свою очередь развивающемуся во взрослую лягушку. Это исследование стало предтечей более поздних экспериментов по клонированию животных.
Однако все еще было непонятно, можно ли целую клетку также заставить «де-дифференцироваться», а потом — превратиться в любую из множества других специализированных клеток. В 2006 году положительный ответ на этот вопрос дал японец Шинья Яманака, использовавший небольшой набор транскрипционных факторов для такого «перепрограммирования». Полученные им клетки получили название индуцированных плюрипотентных стволовых клеток (ИПСК).
Оба этих открытия показали, что казавшееся незыблемым состояние дифференциации при «умелом» воздействии вполне можно отменить и полностью изменить тот путь, по которому предстоит развиваться клетке. Работы этих ученых открыли баснословные перспективы в биологии и медицине.
Предыстория
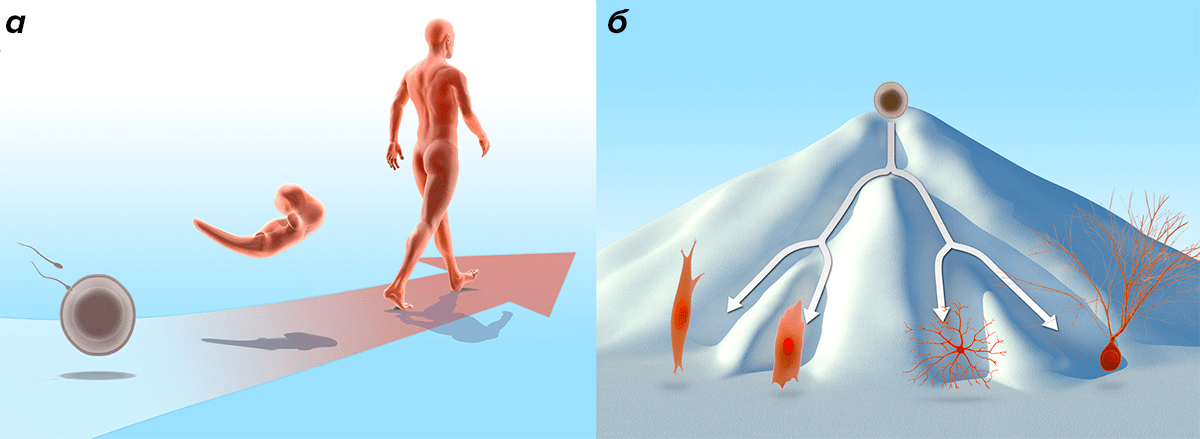
В процессе нормального развития каждая клетка проходит путь от изначального недифференцированного состояния, характерного для оплодотворенной яйцеклетки (зиготы) и клеток раннего эмбриона, до специализированных клеточных форм, медленно делящихся и служащих для выполнения всего спектра клеточных функций (рис. 1а). Наиболее «многофункциональную» клетку — зиготу — называют тотипотентной, то есть, дающей начало абсолютно всем другим типам клеток.
По мере развития, клетки становятся все более специализированными и все менее подверженными «неожиданным» превращениям. Во взрослом организме число стволовых клеток невелико, и они располагаются в строго определенных местах (например, костном мозге), играя роль источника для пополнения популяции дифференцированных клеток. Эта закономерность и сформировала представление, что развитие клеток возможно лишь в одном направлении, и никогда дифференциация не обернется вспять. Конрад Уэддингтон (Conrad Hal Waddington) использовал метафору горного ландшафта, в которой плюрипотентная клетка находится на вершине горы, а специализированные клетки лежат в долинах, «скатываясь» каждая по своей траектории (изображающей путь дифференциации) (рис. 1б). Эта метафора подчеркивает сложность или невозможность обратного пути «в гору» и, значит, превращения одних клеток в другие.
Рисунок 1. Развитие организма и дифференциация клетки. а — Нормальное развитие человека из оплодотворенной яйцеклетки до взрослого организма иллюстрирует идею однонаправленного процесса развития. б — Иллюстрация Уэддингтона [1] для процесса клеточной дифференциации. «Эпигенетический ландшафт» задает путь, который проходит каждая клетка в процессе обретения специализации. Эти картина призвана подчеркнуть, что путь «обратно» невозможен или сильно затруднен.
Однако теоретическая возможность «перепрограммирования» не исключалась полностью; Ханс Шпеман, нобелевский лауреат по физиологии и медицине 1935 года, первым предложил идею «пересадки» ядер дифференцированных клеток в цитоплазму яйцеклетки, чтобы изучить способность к дифференциации.
Перепрограммирование с помощью ядра соматической клетки
Первые попытки пересадки ядер были сделаны не Гардоном; еще в 1952 году Бриггс (Robert Briggs) и Кинг (Thomas King) разработали технологию «пересадки» ядра соматической клетки лягушки Rana pipiens в оплодотворенную икринку, ядро которой предварительно разрушали [2]. Амфибии хорошо подходят для таких экспериментов, потому что их икра крупная и развивается не внутриутробно. В этой работе было показано, что пересадка ядра из эмбриональных клеток действительно может дать начало нормальному головастику, но аналогичный опыт с более дифференцированными клетками к успеху не привел. Поэтому, хотя фактически они проделали ту же работу, что и Гардон несколькими годами позже, им пришлось сделать вывод, что дифференцированные клетки необратимы в своем развитии [3].
Джон Гардон, эмбриолог, закончивший Оксфорд, выбрал для своих опытов другую лягушку — «ветерана» лабораторных исследований Xenopus laevis. Он уничтожал ядро яйцеклетки ультрафиолетовым светом и пересаживал в цитоплазму ядро от дифференцированной клетки эпителия, и в части опытов ему удалось получить нормально плавающих и развивающихся головастиков (рис. 2; [4]). Так что Гардону, в противоположность своим предшественникам, удалось показать именно то, что пересадка ядра от дифференцированных клеток способна вернуть генетическую программу к состоянию плюрипотентности. Однако много лет прошло, прежде чем научное сообщество восприняло эти революционные работы всерьез.
Рисунок 2. Перепрограммирование ядра клетки эпителия лягушки. Гардон использовал ультрафиолет, чтобы разрушить ядро икринки лягушки (1), а потом пересаживал туда другое ядро, полученное из эпителия головастика (2). В большинстве случаев клетки погибли, однако несколько из них развились в головастиков и затем — во взрослых лягушек (3). Этот опыт подтвердил, что генетическая информация сохраняется неизменной на протяжении всего срока жизни клетки, и может в подходящих условиях быть задействована вновь. Более поздние исследования, основанные на том же принципе, привели к клонированию млекопитающих (4).
Исследования Гардона подвели подкоп под парадигму необратимости развития, впервые наглядно продемонстрировав, что ядро дифференцированной клетки вполне может быть возвращено на плюрипотентный этап и дать начало всем типам соматических и половых клеток, — если его поместить в цитоплазму яйцеклетки, «настроенной» на этот режим.
Атака клонов
Работы Гардона положили начало технологии, называемой терапевтическим клонированием (somatic cell nuclear transfer). В 1997 году с помощью этого метода (конечно, с существенными изменениями) появилась на свет знаменитая овечка Долли [5]. Важным дополнением стало то, что ядро перед пересадкой ввергали в покоящееся состояние, что позволяло лучше «синхронизовать» ядро с клеткой, его лишенной. С тех пор уже удалось клонировать довольно много млекопитающих — не только овцу, но и мышь, корову, свинью, волка и степного кота. Метод пересадки ядер также позволил совершить ряд важных открытий в иммунологии.
Эра перепрограммированных клеток
Гардон наглядно доказал, что перенос ядра в окружение раннего эмбрионального развития способен «перезапустить» программу развития. Однако можно ли такое сделать, не извлекая ядро из клетки? Многие ученые продолжали считать это невозможным, полагая эпигенетические изменения, произошедшие в дифференцированной клетке, слишком далеко зашедшими, чтобы можно было их обратить вспять. Наверное, так считал и Яманака, когда он начал заниматься эмбриональными стволовыми клетками (ЭСК) [6], впервые выделенными и культивированными Мартином Эвансом (лауреатом Нобелевской премии по физиологии и медицине 2008 года [7]).
Лаборатория Яманаки работала над поиском факторов, поддерживающих в ЭСК программу плюрипотентности. Было найдено несколько десятков генов, активность которых в ЭСК была намного выше, чем в дифференцированных клетках, и, кроме того, уже открыли, что слияние ЭСК и специализированной клетки может дать две плюрипотентные клетки [8].
Вооруженная этим знанием, группа Яманаки внедрила в клетку (выбрали фибробласт) вектор с 24 генами, заставившими часть клеток дать колонии, подобные стволовым клеткам, и принялась по одному удалять гены из этого набора. В результате был установлен список из всего четырех генов, необходимых для «перепрограммирования» клетки: Myc, Oct3/4, Sox2 и Klf4 (рис. 3) [9]. Полученные клетки, названные Яманакой индуцированными плюрипотентными стволовыми клетками (ИПСК), получались в результате изобретенной процедуры с крайне низким выходом, но применяемые технологии селекции позволяют обнаружить даже одну перепрограммированную клетку на сотни тысяч. Далее последовала серия работ этой и других лабораторий, в которых исследователи оптимизировали состав перепрограммирующих факторов и способ введения вектора в клетку, чтобы повысить эффективность перепрограммирования и снизить вероятность образования опухолевых клеток в результате вызываемой метаморфозы [10].
Об этих и других работах в новой и новейшей истории исследований стволовых клеток «биомолекула» рассказывала в двух больших обзорах: «Была клетка простая, стала стволовая» [10] и «Ствол и ветки: стволовые клетки» [11].
Рисунок 3. Способ перепрограммирования специализированной клетки в стволовую. Начиная с набора 24 транскрипционных факторов и постепенно сужая этот перечень (1), Такахаши и Яманака установили, что всего четыре гена (Myc, Oct3/4, Sox2 и Klf4) могут преобразить фибробласт, вернув его в состояние плюрипотентности (2) [9]. Полученные ИПСК (3) могут давать начало тератомам, что используется как маркер плюрипотентной клетки, а также использоваться в технологии получения химерных мышей (традиционно, для этого использовали ЭСК [7]).
Открытие Яманаки — важнейшее фундаментальное открытие в биологии, поскольку именно оно впервые продемонстрировало, что дифференцированная клетка может снова вернуться в «детство» и стать плюрипотентной. Весьма простая технология получения ИПСК мгновенно была взята на вооружение сотнями лабораторий по всему миру.
Перспективы использования стволовых клеток в медицине
С момента появления технология получения ИПСК была существенно усовершенствована. В частности, теперь не нужно использовать векторы на основе ретровирусов, которые встраиваются в произвольное место генома и могут повредить его или даже запустить программу онкологической трансформации. Теперь используют аденовирусы или другие вирусные векторы, не встраивающиеся в хромосомы, а также РНК, белковые транскрипционные факторы и эписомальные плазмиды. В некоторых случаях число перепрограммирующих факторов можно снизить до одного — например, нейрональные стволовые клетки мыши превращаются в ИПСК введением одного только фактора Oct4 [12].
Открытие Яманаки также сообщило новый импульс поиску способов трансдифференцировки — то есть, превращению одного типа клеток в другой, минуя стадию стволовых клеток. Это возвращает нас в 1960–80-е годы, к работам по имагинальному диску дрозофилы и к таким генам как Antennapedia, MyoD, GATA1 и Pax5. В частности, уже тогда удалось превратить фибробласты в миобласты активацией гена MyoD [13]. Под впечатлением от работ Яманаки быстро нашли способ превратить экзокринные клетки поджелудочной железы в эндокринные [14], а фибробласты — в кардиомиоциты [15]. Есть даже пример превращения друг в друга клеток разных зародышевых листков — мезодермальных фибробластов в эктодермальные нейроны (на что потребовалось три транскрипционных фактора) [16].
Наиболее трепетные ожидания, связанные со стволовыми клетками, заключаются в возможности замещать больные или утраченные клетки прямо в ткани, восстанавливая организм буквально по клеточкам. В самом общем виде такая формула подходит для лечения практически любой болезни — хоть Альцгеймера, хоть Паркинсона, хоть диабета, хоть последствий инфаркта. Конечно, это все находится в туманной дымке светлого будущего, но некоторые реальные перспективы тоже есть. В частности, клеточная терапия с применением ИПСК обещает освободить врачей от проблемы иммунной несовместимости. Конечно, особое внимание нужно уделить безопасности — ведь, как уже было сказано, ИПСК могут иметь как привнесенные при перепрограммировании мутации, так и быть онкогенными сами по себе. В общем, несмотря на то, что ИПСК сулят совершенно баснословные преимущества для медицины, пока что имеется «снежный ком» проблем, связанных с ними [17].
Другая перспектива, уже ставшая твердой действительностью, — возможность получать линии бессмертных клеток (ИПСК), соответствующих различным редким генетическим заболеваниям, и изучать как саму болезнь, так и действие на нее разрабатываемых лекарственных средств (рис. 4) [18]. ИПСК уже получены для таких заболеваний как амиотрофический латеральный склероз (болезнь Шарко), синдром Ретта, спинальная мышечная атрофия (СМА), недостаточность антитрипсина α1, семейная гиперхолестеринемия, а также для различных кардиологических заболеваний. В некоторых из этих клеточных моделей удается связать наблюдаемый фенотип с болезнью: в частности, в случае клеток из СМА, это затухание функций моторных нейронов. Некоторый прогресс есть даже в изучении заболеваний со сложной генетикой, таких как шизофрения.
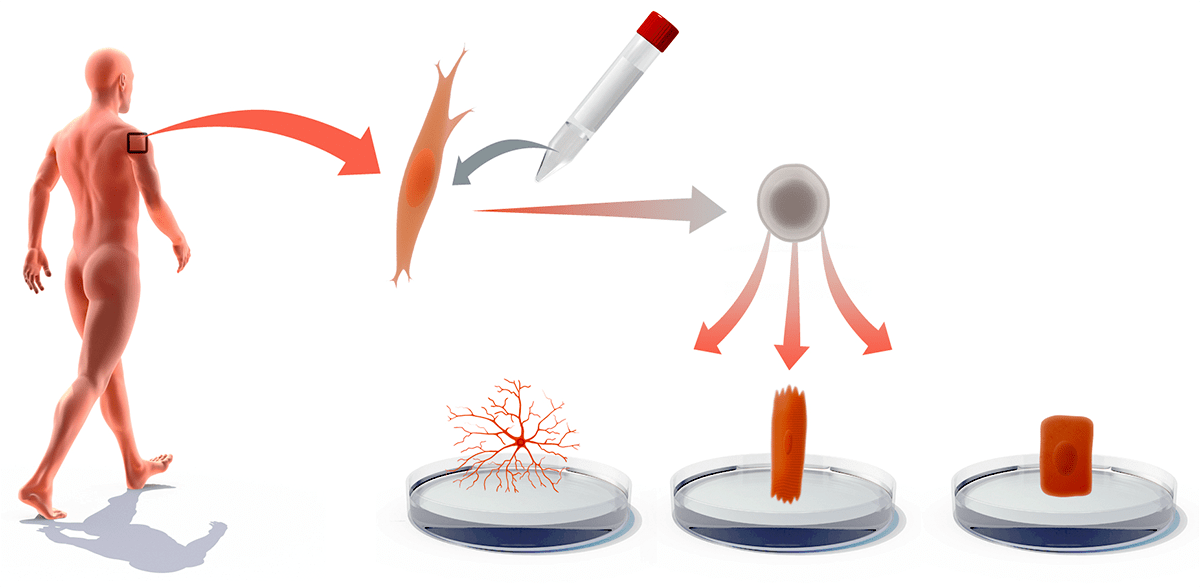
Рисунок 4. ИПСК в медицине. Из тканей пациентов, страдающих различными заболеваниями, можно выделить соответствующие клетки и превратить их в ИПСК. Колонии этих клеток можно дифференцировать в другие типы клеток и использовать их в лечении, или же изучать на них болезнь и действие лекарств.
Исследуют на культурах специфичных для конкретных болезней ИПСК и действие разрабатываемых лекарств. В частности, на модели наследственной вегетативной дистонии проведен скрининг базы химических веществ и найден прототип лекарства кинетин, который способен частично обратить последствия нарушенного сплайсинга гена IKBKAP, вызывающего эту болезнь [19]. Аналогично, показано лекарственное действие бета-блокаторов и блокаторов ионных каналов на ИПСК из модели синдрома удлинения QT интервала [20]. Так ИПСК уже вошли если не в клиническую, то в лабораторную практику и служат «испытательными стендами» для изучения различных болезней и действия на них разрабатываемых лекарств.
Открытие того, что зрелые дифференцированные клетки можно вернуть в плюрипотентное состояние или даже, минуя его, превратить один тип клеток в другой, стало поворотным в эмбриологии, биологии развития и всей молекулярной биологии. Это знание уже осветило все уголки физиологии и медицины, и практические применения в виде новых видов лечения наверняка не заставят себя ждать.