Фентанил или трамадол что сильнее
Фентанил или трамадол что сильнее
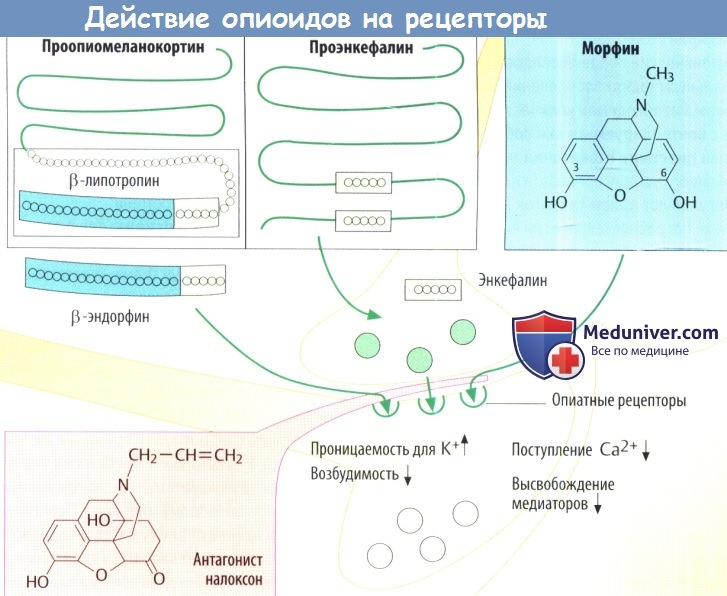
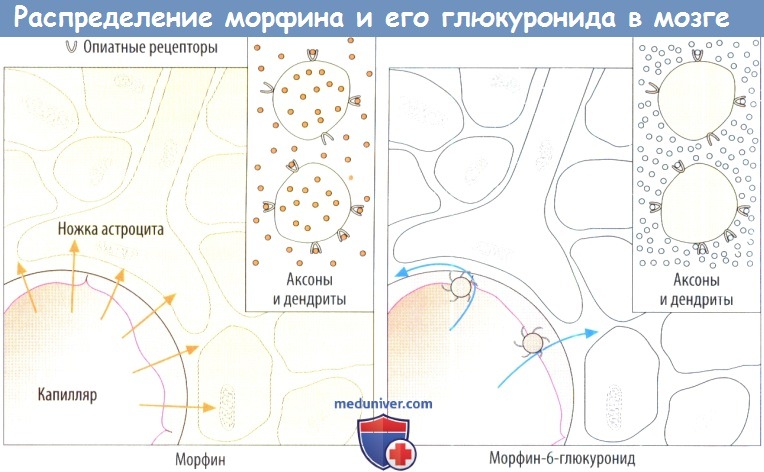
На нервных клетках имеются места связывания эндогенных веществ, известных как эндогенные опиоиды. Опиатные рецепторы присутствуют в различных областях головного мозга, в спинном мозге, а также в нервных сплетениях кишечника и мочевого пузыря. Существуют различные типы рецепторов, которые обозначаются греческими буквами: δ, κ и μ.
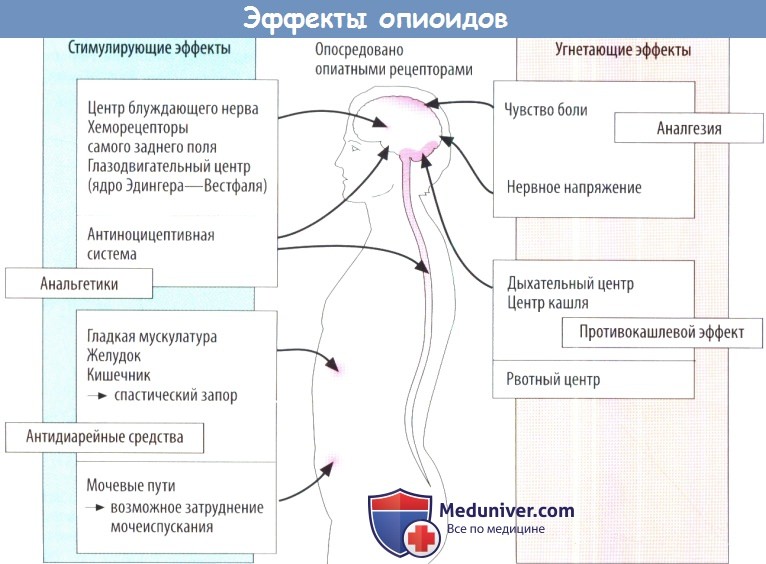
а) Побочные эффекты опиоидов. Опиоиды угнетают дыхательный центр. Даже в терапевтической дозировке обнаруживается снижение чувствительности к напряжению О2 и содержанию СО2 в крови. Особенно чувствителен дыхательный центр у новорожденных, поэтому при возможности опиоиды не следует назначать женщинам во время родов. Для лечения вызванного опиоидами угнетения дыхания у новорожденных эффективен налоксон.
У взрослых с хроническими нарушениями газообмена (при эмфиземе легких) повышена чувствительность дыхательного центра к морфину и его производным. Даже обычная доза может привести к центральному угнетению дыхания. Поэтому опиоиды противопоказаны пациентам с расстройствами газообмена.
При первом использовании опиоидов возможна рвота; этот эффект обусловлен стимуляцией хеморецепторов в самом заднем поле. При регулярном применении опиоидов этот побочный эффект исчезает.
Опиоиды стимулируют парасимпатические ядра, поэтому наблюдается сужение зрачков. Это важно с диагностической точки зрения, т. к. зрачки расширяются только в терминальной стадии угнетения дыхания.
В ЖКТ повышается тонус гладких мышц, ингибируется пропульсивная двигательная активность развивается запор. Замедляется опорожнение желудка, затрудняется отток желчи и секреторная активность поджелудочной железы, опорожнение мочевого пузыря.
б) Толерантность (привыкание). При повторных введениях опиоидов возможно развитие привыкания к их центральным эффектам. Для достижения аналогичного обезболивания требуется постоянно повышать дозу препарата. Толерантность к периферическим эффектам препарата развивается в меньшей степени. Запор вызванный морфином, может стать настолько сильным, что использование опиоидов приходится прекращать. Нередко с самого начала применения опиоидов назначают слабительные средства.
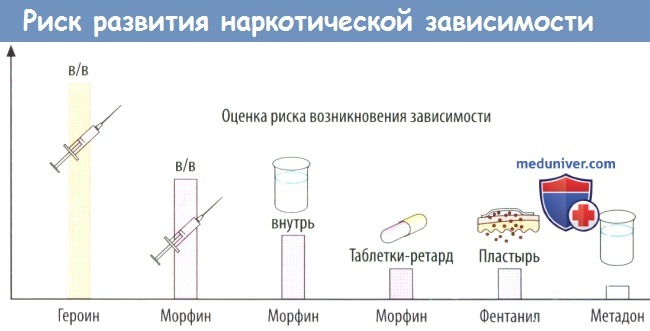
в) Опиоидная зависимость. Помимо соматической толерантности опиоиды также обладают «роковыми свойством способствовать развитию лекарственной зависимости. Зависимость связана с развивающейся при приеме опиоидов эйфорией и при длительном неконтролируемом приеме приводит к тяжелому негативному симптомокомплексу — синдрому отмены при прекращении приема средства. Развивается «опиоидный голод».
Налоксон подходит для парентерального введения исключительно из-за высокой пресистемной элиминации. Налтрексон более устойчив к метаболизму и применяется внутрь. Налтрексон может использоваться как дополнительное лекарственное средство при лечении абстинентного синдрома.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «фармакология»
Фентанил или трамадол что сильнее
Интенсивность боли определяет больной, а не его родственники.
Для оценки эффективности лечения рекомендуется ведение дневника боли с фиксированием даты, времени приема, дозы, пути введения, продолжительности действия и побочных эффектов.
Ступень 1. Лечение слабой боли начинают с нестероидных противовоспалительных средств, которые продаются в любой аптеке без рецепта врача. Препараты подбираются с учетом противопоказаний и индивидуальной переносимости больного. Чем эффективнее лекарство снимает боль, тем вреднее оно для желудка, поэтому при высоком риске гастропатии одновременно рекомендуется омепразол или нольпаза.
Ступень 2. Лечение боли умеренной интенсивности.
На этом этапе к максимальной дозе нестероидного противовоспалительного препарата добавляется минимально эффективная доза трамадола в таблетках. Постепенно доза трамадола увеличивается до 400 мг в сутки (по 50 мг до 8 раз в день или по 100 мг 3-4 раза в день), а таблетки меняются на внутримышечные инъекции по 100 мг 4 раза в сутки каждые 6 часов. Обезболивающее действие наступает через 30-40 минут после приема таблетки или через 5-10 минут после внутримышечной инъекции. Длительность действия от 4 до 6 часов.
Побочные действия. Трамадол часто вызывает тошноту с рвотой, запоры и сонливость. При тошноте и рвоте таблетки можно заменить на инъекции.
Медикаментозная коррекция побочных эффектов такая же, как и при обезболивании на 3 ступени (см. ниже).
Взаимодействие с другими препаратами:
Транквилизаторы, седативные средства взаимно потенцируют эффекты.
Осторожность необходима при одновременном назначении с нейролептиком, антидепрессантом, карбамазепином. Нельзя вводить в одном шприце с диклофенаком, реланиумом.
Комбинации снижают болевой синдром меньшей дозой трамадола и позволяют как можно дольше задержаться на 2 ступени обезболивающей лестницы. При грамотном обезболивании потребность в наркотических анальгетиках можно значительно отсрочить.
При умеренной боли вместо трамадола врач может назначить пластырь дюрагезик 12,5 мкг/час или таргин в таблетках в дозе 2,5 мг/5 мг
Эффективное обезболивание в онкологии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
МГМСУ им. Н.А. Семашко
Е жегодно в мире от злокачественных опухолей умирает 7 млн. человек, из них более 0,3 млн. – в России. Считается, что около 40% больных с промежуточными стадиями процесса и 60–87% с генерализацией заболевания страдают от болевого синдрома различной выраженности. У значительной части этих пациентов болевой синдром отчетливо проявляется лишь на поздних стадиях заболевания, когда специфическое лечение невозможно. Несмотря на однозначный прогноз, больной нуждается в адекватном обезболивании с целью предотвращения действия боли на физическое, психическое и моральное состояние пациента и как можно более долгого сохранения его социальной активности.
Боль у онкологического больного может быть обусловлена непосредственным распространением опухоли (75% случаев), противоопухолевым лечением (20% случаев), в остальных случаях она вообще не связана с опухолевым процессом или противоопухолевым лечением. К настоящему времени достигнут значительный прогресс в обезболивании онкологических больных, однако даже на терминальной стадии они нередко не получают адекватной помощи.
Трудности ведения этих пациентов обусловлены сложностью оценки боли, нежеланием больных принимать обезболивающие препараты, недостаточной доступностью наркотических анальгетиков, а также отсутствием у медицинских работников навыков по купированию болевого синдрома у онкологических больных. Пациенты, находящиеся на амбулаторном лечении, нуждаются в постоянном контроле для коррекции обезболивающей терапии, профилактики и устранения побочных эффектов анальгетиков. В каждом конкретном случае должны определяться и, при необходимости, корректироваться оптимальные дозы препаратов и интервалы между их введением, обеспечивающие стабильное, непрерывное обезболивание.
Фармакотерапию нарастающего хронического болевого синдрома начинают с ненаркотических анальгетиков и переходят, при необходимости, сначала к слабым, а затем к сильным опиатам по трехступенчатой схеме, рекомендованной Комитетом экспертов ВОЗ в 1988 г.:
1. Ненаркотический анальгетик + адъювантные средства.
2. Слабый опиоид типа кодеина + ненаркотический анальгетик + адъювантные средства.
При проведении обезболивающей терапии важно соблюдение следующих основных принципов:
1. Дозу анальгетика подбирают индивидуально в зависимости от интенсивности и характера болевого синдрома, добиваясь устранения или значительного облегчения боли.
2. Назначать анальгетики строго «по часам», а не «по требованию», вводя очередную дозу препарата до прекращения действия предыдущей для предупреждения появления боли.
3. Анальгетики применяют «по восходящей», то есть от максимальной дозы слабодействующего опиата к минимальной дозе сильнодействующего.
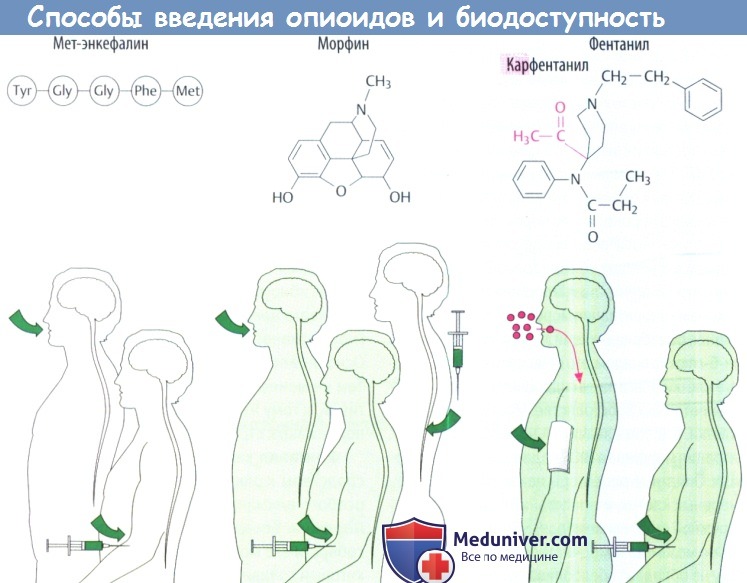
4. Предпочтительно применение препаратов внутрь, использование подъязычных и защечных таблеток, капель, свечей, пластыря (фентанил).
Лечение начинают с применения ненаркотических анальгетиков. Применяют анальгетики–антипиретики (парацетамол) и нестероидные противовоспалительные средства (НПВП) – салицилаты (ацетилсалициловая кислота), производные пропионовой кислоты (ибупрофен, напроксен), производные индол/инден уксусных кислот (индометацин, диклофенак), оксикамы (пироксикам, мелоксикам, лорноксикам) и др. (Ladner E. et al., 2000). Ненаркотические анальгетики действуют путем подавления синтеза простагландинов; при их использовании имеется потолок анальгезии – максимальная доза, при превышении которой не происходит усиления анальгезирующего эффекта. Препараты используются для устранения легкой боли, а также в комбинации с наркотическими анальгетиками при умеренной и сильной боли. НПВП особенно эффективны при боли, вызванной метастазами в кости. У пациентов с высоким риском осложнений со стороны желудочно–кишечного тракта (возраст старше 65 лет, заболевания желудочно–кишечного тракта в анамнезе, сочетанный прием НПВП и глюкокортикоидов и др.) применяют мизопростол в дозе 200 мг 2–3 раза в сутки или омепразол в дозе 20 мг в сутки.
К адъювантным средствам относят препараты, обладающие собственными полезными эффектами (антидепрессанты, глюкокортикоиды, противовоспалительные средства), препараты, корректирующие побочные эффекты наркотических анальгетиков (например, нейролептики при тошноте и рвоте), усиливающие их анальгетическое действие – например, клонидин, антагонисты кальция (Goldstein F.J. 2002, Mercadante S. et al., 2001). Эти лекарственные средства назначают по показаниям: в частности, трициклические антидепрессанты и антиконвульсанты показаны при нейропатической боли, дексаметазон – при повышенном внутричерепном давлении, боли в костях, прорастании или сдавлении нервов, компрессии спинного мозга, растяжении капсулы печени. Следует, однако, отметить, что эффективность адъювантных средств еще должна быть доказана. Так, Mercadante S. et al. (2002) не выявили влияния амитриптилина на интенсивность болевого синдрома, потребность в наркотических анальгетиках и качество жизни у 16 онкологических пациентов с нейропатической болью.
При использовании нового отечественного анальгетика пропионилфенилэтоксиэтилпиперидин гидрохлорида в виде защечных таблеток эффект развивается через 10–30 минут, продолжительность анальгезии колеблется от 2 до 6 часов. Начальная суточная доза пропионилфенилэтоксиэтилпиперидин гидрохлорида составляет 80–120 мг (4–6 таб.), спустя 2–3 недели ее увеличивают в 1,5–2 раза. Пропионилфенилэтоксиэтилпиперидин гидрохлорид рекомендуют использовать при неэффективности трамадола.
При возникновении боли на фоне проводимой обезболивающей терапии используют быстродействующие анальгетики. Самым быстрым действием по сравнению с другими препаратами для лечения раковых больных с хроническим болевым синдромом обладает фентанил. Этот препарат отличается достаточно сильным, но кратковременным анальгезирующим эффектом; он не обладает анальгетическим потолком – прогрессивное повышение дозы приводит к дополнительному анальгетическому эффекту.
Помимо внутривенного введения, используют также пластыри с фентанилом, обеспечивающие постепенное высвобождение препарата в течение 3 суток (Muijsers R.B. et al., 2001). Анальгетический эффект развивается через 12 ч после наложения первого пластыря, при выраженном болевом синдроме для обезболивания в этом промежутке времени возможно внутривенное введение фентанила (Kornick C.A. et al., 2001). Стартовая доза фентанила обычно составляет 25 мкг/час. Дозировка подбирается с учетом предшествующих назначений других анальгетиков и возраста пациента – пожилым людям, как правило, требуется меньшая доза фентанила, чем более молодым.
Самые частые побочные эффекты трансдермального фентанила – запоры (возникающие, однако, реже, чем на фоне перорального приема морфина), тошнота и рвота; наиболее серьезное – гиповентиляция – наблюдается примерно в 2% случаев (Muijsers R.B. et al., 2001).
В таблице 1 представлены препараты, применяемые для лечения болевого синдрома у некурабельных онкологических больных.
1. Enting RH, van der Rijt CC, Wilms EB, Lieverse PJ, de Wit R, Smitt PA. [Treatment of pain in cancer with systemically administered opioids]. Ned Tijdschr Geneeskd. 2001, 19;145 (20): 950–4.
2. Goldstein FJ. Adjuncts to opioid therapy. J Am Osteopath Assoc. 2002, 102 (9 Suppl 3):S15–21.
3. Kornick CA, Santiago–Palma J, Khojainova N, Primavera LH, Payne R, Manfredi PL. A safe and effective method for converting cancer patients from intravenous to
transdermal fentanyl. Cancer. 2001, 15; 92 (12): 3056–61.
4. Kuraishi Y. [Effects of morphine on cancer pain and tumor growth and metastasis]. Nippon Rinsho. 2001, 59(9): 1669–74.
5. Ladner E, Plattner R, Friesenecker B, Berger J, Javorsky F. [Non–opioid analgesics –irreplaceable in cancer pain therapy?] Anasthesiol Intensivmed Notfallmed Schmerzther. 2000, 35(11):677–84.
6. Mercadante S, Portenoy RK. Opioid poorly–responsive cancer pain. Part 3. Clinical strategies to improve opioid responsiveness. J Pain Symptom Manage. 2001, 21(4): 338–54.
7. Muijsers RB, Wagstaff AJ. Transdermal fentanyl: an updated review of its pharmacological properties and therapeutic efficacy in chronic cancer pain control. Drugs. 2001, 61(15): 2289–307.
8. Mystakidou K, Befon S, Kouskouni E, Gerolymatos K, Georgaki S, Tsilika E. Vlahos L. From codeine to transdermal fentanyl for cancer pain control: a safety and
efficacy clinical trial. Anticancer Res. 2001, 21(3C): 2225–30.
9. Опухолевые боли – поэтапная схема ВОЗ. Pharmedicum. –1995, Vol.1: 9–11.
Фентанил или трамадол что сильнее
— трансдермальные терапевтические системы (ТТС) фентанила (пластырь на 72 ч);
— пропионифенилэтоксиэтилперидин (просидол) — защечные таблетки;
— трамадола гидрохлорид в виде таблеток;
— трамадола гидрохлорид в виде капсул.
В 2017 г. в нашу страну поступил и начал применяться еще один препарат — оксикодон + налоксон (таргин), который был зарегистрирован в России 2015 г.
Для правильного выбора, какой из трех препаратов следует предпочесть в каждой клинической ситуации, необходимо более детально изучить все особенности, преимущества и недостатки каждого из них.
1. Морфин
Лекарственные взаимодействия и предостережения
Морфин усиливает действие снотворных, седативных, местно-анестезирующих лекарственных средств, препаратов для общей анестезии и анксиолитиков.
Применение
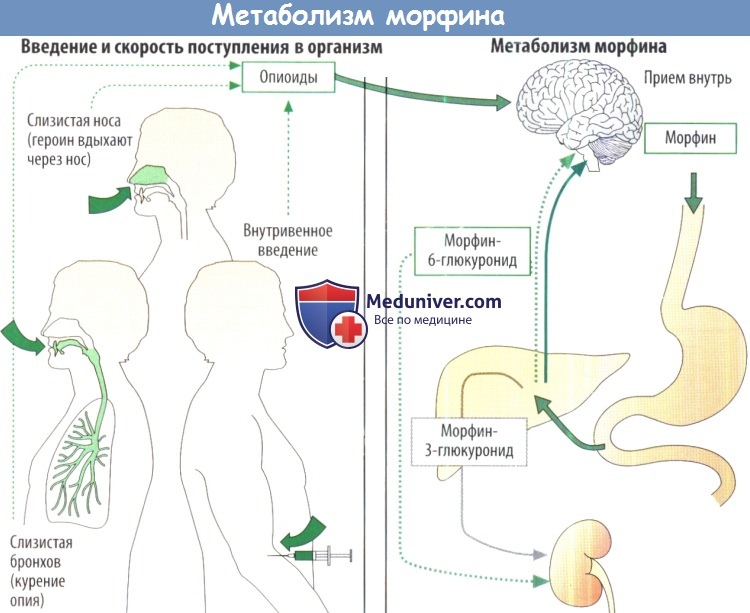
Морфин производят во многих странах в самых разнообразных неинвазивных формах: свечи, таблетки, капсулы, раствор или сироп для приема внутрь. Капсулы и таблетки производят двух видов: быстрого действия и продленного действия (на 12 или 24 ч). Есть формы препаратов с быстрым высвобождением, которые позволяют более точно назначить (титровать) необходимую и безопасную дозу для пациента (такие формы пока у нас не зарегистрированы).
Согласно рекомендациям ВОЗ, а также национальным рекомендациям США, Канады, Великобритании и некоторых других стран, пероральный путь введения препаратов является предпочтительным, начиная со второй ступени (при умеренной боли), если есть такая возможность. Лекарственные препараты следует вводить наиболее эффективным, удобным и наименее болезненным способом [3—7].
Однако уже давно установлено, что трамадол (как и кодеин) не у всех пациентов эффективен. Это связывают с выраженным генетическим полиморфизмом цитохрома Р4502Д6: у 6% населения (европеоидного типа), имеющих от природы повышенную активность этой цитохромной системы, эффект трамадола будет значительно выше, а у 8—10% лиц, у которых этот фермент ослаблен, обезболивание будет неэффективным [9].
Таким образом, почти каждый десятый пациент может иметь недостаточный эффект при обезболивании трамадолом (или кодеином), и это будет показанием к переходу на малые дозы сильных опиоидных препаратов.
Rp: Tabl. Morphini 0,03 № 40 (сорок)
Rp: Caps. Morphini 0,03 № 40 (сорок)
S: по 1 капс. 2 раза в сутки
2. ТТС фентанила
Общие сведения. История создания фентанила составляет всего 57 лет. В 1959 г. его синтезировал немецкий химик Пол Янссен, и с 1960 г. он применяется для проведения анестезии во время оперативных вмешательств [1].
Особенности фармакологии фентанила
Поскольку фентанил является высокоактивным опиоидным препаратом, во многих зарубежных руководствах не рекомендуется применять ТТС фентанила у опиоид-наивных пациентов (тех, кто раньше не принимал опиоиды) [10—13].
Биодоступность фентанила из ТТС весьма вариабельна. Указанные дозы препарата в мкг/ч, как правило, отражают среднее количество лекарственного средства, поступающего пациенту в течение времени предписанного для применения ТТС. Безусловно, у разных пациентов имеются индивидуальные особенности диффузии препарата, от чего будет зависеть его поступление в системный кровоток. Так, например, для ТТС 100 мкг/ч средняя (±SD) доставка составляет 97 (±15) мкг/ч, а количество неиспользованного фентанила в пластыре через 3 дня может варьировать от 30—85% исходного содержимого [18, 19].
У пациентов в состоянии кахексии концентрация фентанила в плазме снижается на 1/3 — 1,2, что вероятно связано с истощением подкожно-жировой клетчатки, а также со снижением гидратации кожи [20, 21].
Лекарственные взаимодействия
Фентанил метаболизируется посредством CYP3A4. Поэтому при одновременном применении лекарственных средств, ингибирующих этот цитохром (флюконазол, вориконазол, циметидин, антибиотики группы макролидов: эритромицин, кларитромицин, грейпфрутовый сок), повышается плазменная концентрация препарата (ингибируется распад фентанила в печени), а карбамазепин, фенитоин, фенобарбитал, рифампицин индуцируют активность CYP3A4, соответственно снижая эффективность фентанила за счет усиления метаболизма.
Предостережения
Современные пластыри матриксного типа не рекомендуется разрезать, хотя теоретически это безопасно и не вызывает проблем. После регистрации и появления ТТС в минимальной дозе — 12 мкг/ч, титрование стало достаточно точным, и, по данным зарубежных авторов, сейчас нет необходимости в их разрезании [6].
Разрешенные начальные дозы для ТТС фентанила в качестве сильного опиоида в Великобритании составляют 12—25 мкг/ч в зависимости от предшествующей терапии, а доза 12 мкг/ч признана наиболее безопасной начальной дозой для полностью опиоиднаивных пациентов и для некоторых ослабленных пациентов, получающих низкие дозы слабого опиоида при умеренной боли. Нежелательные эффекты (тошнота и рвота) чаще встречаются у опиоид-наивных пациентов. С целью предотвращения побочных явлений не рекомендуется ежедневно повышать дозу ТТС [22].
В рекомендациях Европейской ассоциации паллиативной помощи от 2012 г. отдельный раздел посвящен использованию ТТС фентанила и ТТС бупренорфина, в котором указано, что эксперты не выявили никаких достоверных различий в эффективности между препаратами для трансдермального применения и другими опиоидами, но было отмечено превосходство ТТС в отношении риска развития запора и предпочтений пациентов. Это свидетельствует о том, что в ряде случаев опиоиды в форме ТТС являются удобными и эффективными обезболивающими средствами у пациентов, ранее не получавших опиоиды 3-й ступени [3].
В российских национальных клинических рекомендациях «Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи», рекомендуется использовать ТТС как средство выбора у пациентов, которым по различным причинам невозможно назначить препараты перорально или трансмукозально (защечно или под язык), например, при мукозитах, язвенном или опухолевом поражении слизистой оболочки полости рта, дисфагии, а также при боли постоянного характера. Исключением являются пациенты с выраженной кахексией, повышенным потоотделением и нарушениями целостности кожных покровов [23].
Выписка препарата на рецептурном бланке
Препарат выписывается на рецептурном бланке формы № 148−1/у-88, № 148−1/у-04 (л), № 148−1/у-06 (л).
В соответствии с МНН пластыри фентанила следует выписывать следующим образом:
Rp: ТТS Fentanyli 25 mkg/h № 10 (десять)
S: по 1 пластырю на 3 суток
Максимальное количество препарата, выписываемое на одном рецептурном бланке, может быть увеличено при оказания медицинской помощи ым пациентам, но не более чем в 2 раза.
Оксикодон
Фармакология
Оксикодон является сильным опиоидом, по своим свойствам подобен морфину, но сильнее его в 1,5 раза. Биодоступность препарата при пероральном приеме составляет 75% (60—87%), начало действия — через 20—30 мин после перорального приема препарата быстрого высвобождения, а время достижения пиковой концентрации в плазме 1—1,5 ч. Период полувыведения из плазмы 3,5 ч, продолжительность действия 4—6 ч [27].
Метаболизм оксикодона и предостережения при его применении
Оксикодон метаболизируется главным образом путем образования нороксикодона посредством CYP3A4, но около 10% оксикодона превращается в оксиморфон посредством изофермента CYP2D6 [33, 34].
Около 20% оксикодона выводится с мочой без изменений. При умеренной печеночной недостаточности период полувыведения увеличивается примерно на 2 ч. При почечной недостаточности концентрация оксикодона в плазме увеличивается на 50%, а период полураспада удлиняется на 1 ч. Хотя, по мнению некоторых авторов, оксикодон не рекомендуется при тяжелой почечной недостаточности, он достаточно широко используется как альтернатива морфину при слабой и умеренной степени почечной недостаточности [37].
Мощное обезболивающее действие оказывает именно молекула оксикодона, а не его метаболиты, поэтому, как и фентанил, оксикодон является препаратом выбора при нарушениях функции почек, хотя выводится преимущественно с мочой, и выделительная функция почек напрямую влияет на уровень оксикодона в крови [38].
Использование оксикодона должно сопровождаться профилактическим назначением слабительных, поскольку, подобно морфину, оксикодон сильно тормозит перистальтику кишечника.
С целью уменьшения серьезных побочных эффектов оксикодона, главным образом со стороны желудочно-кишечного тракта (ЖКТ), в конце прошлого века был создан комбинированный препарат оксикодон с налоксоном, где налоксону отведена роль антидота в конкурентном влиянии опиоида оксикодона на перистальтику кишечника. Поскольку налоксон имеет бóльшее сродство к опиоидным μ2-рецепторам, которые расположены в стенке кишечника, он блокирует их и не дает возможности воздействовать на них оксикодону. Таким образом, оксикодон активно всасывается в ЖКТ (до 75%) и поступает в системный кровоток, после чего оказывает основное обезболивающее действие, а налоксон, который практически не всасывается в ЖКТ (3%), обеспечивает хороший кишечный пассаж на фоне приема сильного опиоида. Применяется у неонкологических пациентов с умеренной и сильной болью, у онкологических больных для длительной опиоидной терапии. Препарат под брендовым названием таргин широко применяется в Америке и в Европе, зарегистрирован также в России и поступит для использования в 2017 г. Учитывая, что препарат впервые будет применяться в нашей стране, в представленном обзоре более подробно приведены правила его клинического использования [38].
Применение
Комбинированный препарат, содержащий оксикодон и налоксон (антагонист опиоидных рецепторов), в виде таблеток продленного действия таргин (Targin) зарегистрирован в России следующих дозах:
— налоксон 2,5 мг/оксикодон 5 мг;
— налоксон 5 мг/оксикодон 10 мг;
— налоксон 10 мг/оксикодон 20 мг;
— налоксон 20 мг/оксикодон 40 мг.
Таблетки пролонгированного действия принимают независимо от приема пищи, с достаточным количеством жидкости, не следует их делить или раздавливать.
Таблетка пролонгированного действия содержит двойную полимерную матрицу, предназначенную только для перорального использования. Предполагается, что при нецелевом использовании инъекционное введение компонентов таблетки (особенно тальк) могут вызвать локальный некроз тканей и гранулему легких или привести к другим серьезным, потенциально смертельным эффектам.
Минимальная дозировка препарата содержит всего 5 мг оксикодона и 2,5 мг налоксона, она используется в следующих ситуациях:
— для подбора эффективной дозы в начале терапии;
— при составлении необходимой промежуточной дозы (например, доза 15 мг по оксикодону);
— для постепенного снижения дозы препарата в случае его полной отмены.
В проведенных клинических исследованиях высокие дозы препарата хорошо переносились вплоть до 120/60 мг/сут. Однако число пациентов, получавших эту дозу, было недостаточным для ее официальной регистрации.
Максимальная суточная доза, согласно инструкции к препарату, определена в пределах 40/80 мг налоксон/оксикодон, что соответствует приему пролонгированных таблеток в дозе 40 мг/сут (по оксикодону) 2 раза в сутки.
За рубежом пациентам, которым требуются более высокие дозы препарата, рекомендуют принимать дополнительно оксикодон пролонгированного действия в те же временные интервалы в пределах максимальной общей суточной дозы 400 мг оксикодона пролонгированного действия. В этих случаях при приеме дополнительной дозы оксикодона положительное действие налоксона на пищеварительный тракт частично нивелируется.
Назначение налоксона/оксикодона одновременно с морфином (инъекционным или перорально) в качестве дотации нежелательно или требует постоянного мониторинга состояния пациента, поскольку эти препараты оказывают синергетическое действие при одновременном назначении [28—31].
В соответствии с зарегистрированной инструкцией препарат налоксон/оксикодон не предназначен для терапии острой боли или прорывов боли, поскольку не является быстродействующим, однако появились отдельные работы по применению его в терапии послеоперационной боли [40, 41].
Для лечения прорыва боли разовая доза опиоид