индекс ланжелье это что
Индекс ланжелье это что
Индекс стабильности Ланжелье (LSI) и индекс стабильности Ризнера. Практическое применение.
Индекс стабильности Ланжелье (LSI) и индекс стабильности Ризнера.
Практическое применение.
Для расчетного определения индекса Ланжелье требуется располагать следующими данными: текущее значение рН воды, общее солесодержание воды в г/л (по сухому остатку или производное от электрической проводимости воды), содержание кальция в мг/л, общая щелочность в мг-экв/л, температура воды в o C.
Расчет индекса Ланжелье (LSI):
LSI = pH0 – pHs
рН0 — значение водородного показателя, измеренное с помощью рН-метра;
рНs — значение водородного показателя в предполагаемых условиях насыщения данной воды карбонатом кальция. Согласно СНиП 2-04-02-84, рНs определяется по номограмме, приведенной на рис. 1.
Рис. 1, исходя из значений содержания кальция ССа, общего солесодержания Р, щелочности Щ и температуры воды t.
Пример. Дано: ССа = 100 мг/л; Щ = 2 мг-экв/л; Р = 3 г/л; t = 40 °С.
Для различных условий, также, существуют различные формулы для расчета рНs и Индекса Ланжелье. Ниже приведен один из примеров такой формулы.
Расчет pHs
D = lg [общая щелочность воды, выраженная в мг/кг CaCO3]
TDS – общее солесодержание, мг/л
LSI = pH0 – pHs
рН0 – измеренное значение рН воды в системе
Как использовать полученные значения Индекса Ланжелье (LSI) в практике?
Значение Индекса Ланжелье показывает:
LSI
Для применения в таких системах были разработаны ингибиторы коррозии и отложений, ориентированные на предотвращение коррозии черных металлов. К таким реагентам относится Drewgard 189E.
pH = 8,0
TDS = 400 мг/л
Жесткость по Ca = 150 мг/л CaCO3
Общая щелочность = 50 мг/л CaCO3
1) при T = 25 o C
pHs = ( 9,3 + (lg (400) – 1)/10)+(-13,12 х lg(25+273)+34,55)-(lg(150)-0,4) + lg(50))
pHs = (9,3 + 0,16 + 2,088) – (1,78 + 1,7)
О некоторых особенностях расчёта индекса стабильности воды Ланжелье
Концентрация углекислого газа в воде имеет лишь косвенное отношение к её стабильности. Оценка индекса стабильности воды Ланжелье при детальном рассмотрении сводится к сравнению результата перемножения концентраций ионов кальция и карбонат-ионов (с учётом ионной силы раствора) со значением произведения растворимости карбоната кальция. Более или менее точный расчёт рН и щёлочности, соответствующих полному насыщению воды карбонатом кальция, при нынешнем уровне развития науки о химии воды невозможен.
При рассмотрении показателя стабильности воды часто упоминается такая величина, как «агрессивная углекислота». Как известно, в природной воде всегда содержится растворённый углекислый газ, находящийся в состоянии динамического равновесия как с воздушной средой согласно закону Генри-Дальтона, так с производными диссоциации угольной кислоты — гидрокарбонат[НСО32–] и карбонат-ионами [СО32–]. При этом угольная кислота и её производные в природных водах преобладают среди слабых кислот. В то же время преобладающими катионами в природных водах являются Ca2+, Mg2+, Na+, Fe2+, Fe3+, Из всех солей, которые могут быть образованы катионами и анионами НСО32– и СО32–, наименьшей растворимостью (произведением растворимости — ПР) в воде обладает карбонат кальция CaCO3, вокруг образования или растворения которого и строится задача определения стабильности воды.
Так как непосредственно СО2 в формулу произведения растворимости СаСО3 не входит, то и формально не влияет на стабильность воды. При этом в литературе (например, в [1]) можно встретить следующее уравнение между различными формами угольной кислоты:
2 НСО3– ↔ СО32– + СО2 + Н2О. (1)
Согласно устоявшемуся мнению, для поддержания в растворе определённой концентрации гидрокарбонатных ионов требуется соответствующее этой концентрации количество угольной кислоты — это количество и называется «равновесной углекислотой».
Если количество находящегося в растворе углекислого газа превышает равновесное, то избыток СО2способен вступать в реакцию с твёрдым карбонатом кальция и вызывать его растворение:
СаСО3 + СО2 + Н2О ↔ Са(НСО3)2. (2)
Воду, содержащую свободную углекислоту в концентрации, превышающей равновесную, называют «агрессивной».
Наоборот, при недостатке СО2 по сравнению с равновесной концентрацией возникает тенденция к распаду части гидрокарбонат-ионов, то есть к сдвигу равновесия в уравнении (1) вправо с образованием дополнительного количества СО2 и одновременно СО32–, что в свою очередь приводит к реакции:
Са2+ + СО32– = СаСО3, (3)
при этом СаСО3 будет выпадать в осадок.
Возможны также условия, когда содержание в воде свободной углекислоты совпадает с равновесной — в этом случае вода считается стабильной.
В [2] отмечается, что часть свободной углекислоты, находящейся в равновесии с бикарбонатами (то есть гидрокарбонатами), имеет название «равновесной» и не вступает в химические реакции.
Таким образом, углекислый газ, согласно уравнению (1), «назначен» ответственным за показатель стабильности воды. Хотя такую же важную роль в уравнении (1) могут играть и НСО3–, и СО32–. НСО3– точно так же, в зависимости от концентрации, можно разделить на «равновесный» и «агрессивный» гидрокарбонат-ион, при котором образуется хорошо растворимый гидрокарбонат кальция.
СО32– можно рассматривать «равновесный» и «избыточный» — когда начинается активное образование СаСО3 и его выпадение в осадок. Также не вполне понятно, с какими веществами в природных водах углекислый газ вообще может вступать в химические реакции (помимо участия в углекислотном равновесии).
Следует отметить, что в уравнении (1) вовсе не присутствует такой компонент, как ион Н+, хотя сам индекс стабильности Ланжелье и определяется как разность рН исходной воды и рН той же воды, насыщенной карбонатом кальция (рНs). Здесь логика рассуждений в каком-то смысле распадается — непонятно, каким образом содержание углекислоты (свободной, агрессивной, равновесной — неважно) связано с активной реакцией воды рН, если в уравнении (1) не участвует Н+? Да и само понятие «углекислота» скорее затрудняет понимание вопроса, так как не всегда ясно, что имеется в виду: молекулярная H2CO3, растворённый углекислый газ, гидрокарбонаты или карбонаты.
Таким образом, уравнение (1), связывающее различные формы угольной кислоты, является неполным. В полном виде оно записывается как:
H2CO3 ↔ H2O + CO2 ↔ H+ + HCO3– ↔ 2 H+ + CO32–. (4)
Только такая запись позволяет понять, как стабильность воды зависит от щёлочности и рН.
Содержание свободной двуокиси углерода обычно определяется по номограммам (рис. 1 из [3]). Как видно из рис. 1, концентрацию [CO2] определяют в зависимости от щёлочности Щ, рН воды, температуры и общего солесодержания.
Рассчитать содержание углекислого газа в воде [CO2] можно и с помощью формул, основанных на теории буферных растворов Хендерсона-Хассельбаха (подробнее см. в работе [4]).
В частности, концентрацию [CO2] можно оценить исходя из зависимостей:
где Щ — щёлочность воды, моль/л; [HCO3–] — концентрация гидрокарбонат-ионов, моль/л; Кд1 и Кд2 — константы диссоциации (равновесия) для обеих частей реакции:
H2O + CO2 ↔ H+ + HCO3– и H+ + HCO3– ↔ 2 H+ + CO32– – Кд1 = 4,45 × 10–7,
Кд2 = 5,6 × 10–11 при 25 °C (надо отметить, что в справочниках по неорганической химии приводятся и иные значения Кд1 и Кд2); [H+] — концентрация ионов водорода, моль/л.
Формулы (5) и (6) учитывают все параметры, по которым определяется [CO2] согласно номограммам из [3], кроме солесодержания. Этот параметр для пресных вод (с минерализацией до 1 г/л) можно оценить с помощью коэффициента активности аниона fHCO3–, определяемого по формуле Дебая-Хюккеля:
где z — заряд иона; I — ионная сила раствора, рассчитываемая по формуле:
где ci — молярные концентрации ионов, моль/л; zi — заряды ионов.
Для упрощения расчётов введено допущение, что вся минерализация (сухой остаток) представлена в виде хлорида натрия NaCl. Тогда при молярной массе NaCl, равной 58,44 г/моль:
где М — минерализация воды, мг/л.
С учётом минерализации воды формула (6) примет вид:
где [CO2]f — концентрация углекислого газа с учётом коэффициентов активности иона fH+ и fHCO3–; fH+ и fHCO3– — коэффициенты активности ионов водорода и гидрокарбонат-ионов.
Коэффициенты активности fH+ и fHCO3–, учитывая одинаковые по модулю заряды этих ионов, согласно формуле (7) будут равны:
коэффициенты активности, соответственно, fCa2+ и fCO32–:
В табл. 1 представлены необходимые исходные данные для дальнейших расчётов (анализы воды из подземных источников — водозаборных скважин Московской области).
Следует отметить, что при расчётах по формуле (5), в принципе, следует также учитывать коэффициент активности иона fH+, однако структура выражения (5) такова, что fH+ на результаты расчётов почти не влияет.
Расчёты концентрации [CO2] согласно номограммам на рис. 1 из [3] представлены в табл. 3.
Хотя графические построения и вычисления по номограммам обладают известной субъективностью, но нетрудно заметить, что концентрации [CO2] («свободной углекислоты») в табл. 3 превышают аналогичные значения в табл. 2. Это несоответствие, как уже отмечалось, возникает из-за отождествления показателя щёлочности Щ и содержания гидрокарбонат-ионов [HCO3–], хотя на самом деле [HCO3–] всегда меньше Щ, пусть и на ничтожную величину.
Содержание свободной углекислоты (правильнее — растворённого углекислого газа) в мг/л определяют также по формуле (см. в [6]):
При внимательном рассмотрении формула (12) аналогична формуле (9) за исключением опять же использования щёлочности Щ вместо содержания гидрокарбонат-ионов [HCO3–].
Содержание равновесной углекислоты [CO2]p с учётом ионной силы раствора I, согласно [6], вычисляется по формуле:
Учитывая, что [HCO3–] в рамках общепринятого подхода с трудом поддаётся расчёту, содержание [CO2]р в [6] предлагается оценивать с помощью не слишком наглядных номограмм (рис. 2 из [6]), хотя для этого существуют простые и удобные формулы (5) и (6). Авторы в [6] отмечают, что щёлочность Щдействительно равна сумме концентраций [HCO3–] и [CO32–], но при этом опять же выделяют некую «гидратную щёлочность» [OH–].
Не вдаваясь в подробный разбор формул (12) и (13), следует отметить, что оценка содержания углекислоты (углекислого газа) — свободной, равновесной, агрессивной — для расчётов стабильности воды скорее затрудняет понимание процесса, чем способствует решению технологических задач. Ведь в самом определении произведения растворимости применительно к карбонату кальция учитываются только концентрации [Ca2+], [CO32–] и коэффициенты активности fСa2+ и fCO32–, которые зависят от минерализации воды. А содержание [CO32–] определяется состоянием динамического равновесия, в котором находится углекислотный буферный раствор, которым и является подавляющее большинство природных вод, по крайней мере, подземных. В этом смысле расчёты растворенной углекислоты и её разновидностей представляются излишними. Правда, существует общепризнанная методика определения концентрации агрессивной углекислоты, описанная в сборнике [7].
Данная методика основана на определении разности щёлочности исходной воды и щёлочности после добавления в эту воду порошка мрамора (который имеет в своей основе CaCO3) с последующей выдержкой в течение шести часов или пяти суток в зависимости от способа проведения анализа. Затем эта разность пересчитывается на содержание углекислоты (растворенного углекислого газа).
Таким образом, анализ на агрессивную углекислоту носит скорее косвенный характер, так как фактически в ходе эксперимента стараются достичь образования насыщенного раствора карбоната кальция. В этом случае при избытке осадка карбоната кальция образуется насыщенный раствор, в котором произведение концентраций [Ca2+] и [CO32–] (с учётом коэффициентов активности) равно произведению растворимости ПРCaCO3 при данной температуре.
Чаще всего в литературе приводится значение произведения растворимости ПРCaCO3 при 25 °C, равное 4,8 × 10–9. Учитывая, что в формуле СaCO3 и у кальция, и у карбонат-иона индексы равны единице, то при полном насыщении исходной воды частицами карбоната кальция теоретически представляется верной формула:
Следовательно, при определении индекса Ланжелье для насыщенной карбонатом кальция воды содержание карбонат-ионов [CO32–] следовало бы всегда принимать равным 6,93 × 10–5 моль/л, уточнив его только с учётом температуры и минерализации воды. Однако такое допущение представляется не вполне правомерным по двум причинам:
— во-первых, в подавляющем большинстве случаев в природных водах концентрации [Ca2+] и [CO32–] сильно различаются, и трудно предположить, что при добавлении твёрдого карбоната кальция они будут увеличиваться в одинаковой степени;
— во-вторых, выпадение осадка начинается, когда произведение концентраций [Ca2+] × [CO32–] достигнет ПРCaCO3 вне зависимости от соотношения [Ca2+] и [CO32–].
Во всяком случае, вопрос о предельных равновесных концентрациях при экспериментальном насыщении воды карбонатом кальция можно рассматривать отдельно и более подробно с точки зрения неорганической химии. Но даже если принять величину [Ca2+] = [CO32–] = 6,93 × 10–5 моль/л, то это в целом не помогает при расчёте Щs — щёлочности при предельном насыщении воды карбонатом кальция, необходимой для определения индекса Ланжелье.
Дело в том, что составляющие углекислотного буферного раствора — Н+, СО2, НСО3–, СО32– — находятся в состоянии динамического равновесия, и увеличение или снижение концентрации одного из этих составляющих, например, содержания [CO32–] до 6,93 × 10–5 моль/л, сразу вызовет перераспределение концентраций других составляющих, в том числе [Н+], то есть рН воды.
Строго говоря, любое воздействие на данную систему, будь то снижение [CO2] при аэрации, добавление кислот, щелочей, вызывающих изменение [Н+], гидролиз коагулянтов, обработка воды ионным обменом и другие технологические приёмы водоподготовки изменяют состояние углекислотного равновесия, которое влияет на химические свойства обрабатываемой воды. Эти изменения можно рассматривать на качественном уровне, но провести точную оценку, как изменится рН или щёлочность, при современном уровне развития теории буферных растворов, невозможно.
Таким образом, в известной формуле для расчёта «рН равновесного насыщения воды карбонатом кальция»:
(хотя в [5] было показано, что более правильно использовать в ней коэффициент 7,3 вместо 7,6) значение щёлочности Щ (точнее — [HCO3–]) должно соответствовать состоянию равновесного насыщения, то есть Щs, оценить которое не представляется возможным.
С другой стороны, использование индекса стабильности Ланжелье J наглядно на качественном уровне показывает изменение состояния водного раствора при его насыщении карбонатом кальция.
Предположим, по результатам анализов и расчётов J´ = рН – рНs = 7,5 – 7,05 = +0,45, что указывает на склонность воды к выделению CaCO3. Это означает, что при насыщении воды карбонатом кальция некое количество карбонат-ионов CO32– вступит в реакцию с Ca2+ с образованием осадка. Снижение концентрации [CO32–] в свою очередь приведёт к изменению концентрации [НCO3–] (понижению или повышению — вопрос дискуссионный), но менее значительному, чем [CO3 2–], за счёт буферных свойств раствора.
Тогда, согласно уравнению
рН воды действительно снизится. Можно аналогичным образом описать и обратную ситуацию, когда J
Тогда при значении J´ 0 — склонной к выделению карбоната кальция.
Значение [CO32–] [моль/л] можно оценить, исходя из уравнения углекислотного равновесия в воде (см. [4]):
Расчётные величины согласно выражениям (11), (18), (19) сведены в табл. 4. В табл. 4 также представлены значения индекса Ланжелье, вычисленные по формуле из [5]:
где [Ca2+] подставляется в мг/л, [HCO3 –] — моль/л, отсюда J = рН – рНs. (21)
Из табл. 4 видно, что значения J и J´ различаются незначительно. Более точно рассчитать J´ затруднительно из-за несовершенства метода оценки значений коэффициентов активности Ca2+ и CO32–, что связано с ограничениями, накладываемыми на теорию разбавленных сильных электролитов Дебая-Гюккеля (подробное рассмотрение данного вопроса в задачу автора не входит).
С другой стороны, незначительная разница между J и J´ приводит к следующему выводу: расчёт индекса Ланжелье J заключается не в сравнении исходных значений рН или щёлочности со значениями рНs и Щs, соответствующими состоянию полного насыщения воды карбонатом кальция, а в сравнении результата умножения концентраций [Ca2+] и [CO32–] (конечно, с учётом ионной силы раствора) с произведением растворимости ПРCaCO3.
Действительные значения рНs и Щs при нынешнем уровне развития химической науки расчёту не поддаются.
Выводы
2. Влияние ионного состава воды на её стабильность оценивается через показатель ионной силы раствора I.
3. Показано, что при расчёте индекса стабильности Ланжелье сравниваются не исходные значения рН или щёлочности со значениями рНs или щёлочности Щs, соответствующие предельному насыщению этой воды карбонатом кальция, а произведение концентраций [Ca2+] и [CO32–] со значением ПРCaCO3 с учётом температуры и солесодержания.
4. Прогноз изменения концентраций всех составляющих углекислотного буферного раствора — [CO2], [HCO3–], [CO32–], а также рН воды — при каком-либо воздействии на систему при нынешнем уровне знаний о свойствах воды невозможен; одной из задач химической науки является совершенствование теории буферных растворов, которое позволило бы проводить подобные расчёты, что явилось бы технологическим прорывом в водоподготовке.
Анализ воды: цели, методы, прогнозирование свойств
* Продолжение. Начало см. «С.О.К.» №№ 5–6/2005.
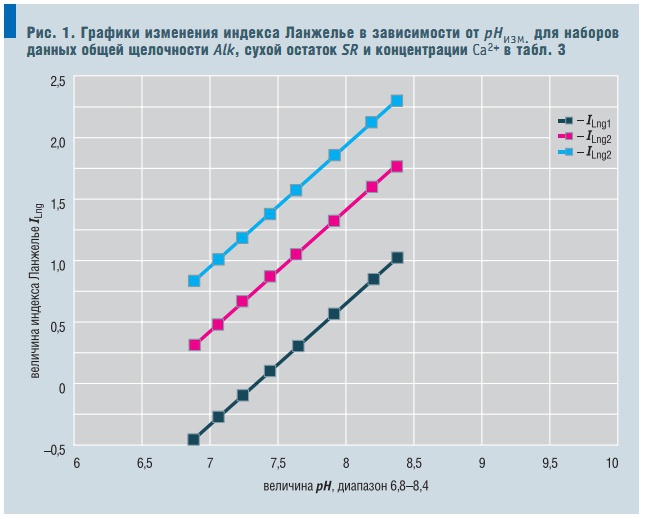
Рис. 1. Графики изменения индекса Ланжелье в зависимости от рНизм. для наборов данных общей щелочности Alk, сухой остаток SR и концентрации Са2+ в табл. 3
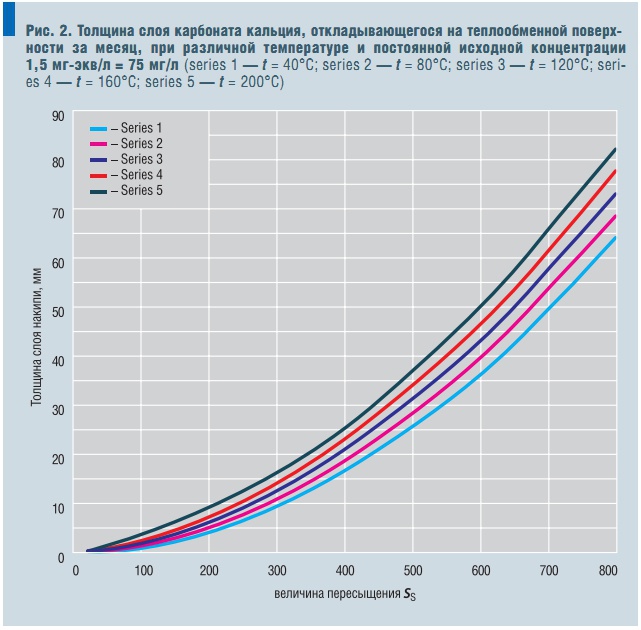
Рис. 2. Толщина слоя карбоната кальция, откладывающегося на теплообменной поверхности за месяц, при различной температуре и постоянной исходной концентрации 1,5 мг-экв/л = 75 мг/л
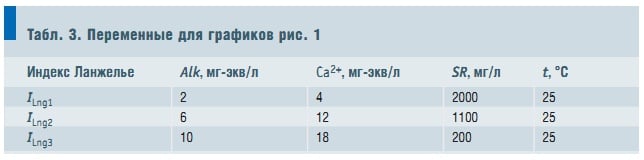
Табл. 3. Переменные для графиков рис. 1
3.2. Дальнейшее развитие метода оценки коррозионно-накипных свойств природной воды
Сложность расчетов индекса Ланжелье привела к тому, что за последние 60 лет предпринимались неоднократные попытки упростить и усовершенствовать метод, предложенный им.
3.2.1. Индекс стабильности Ризнара (ИСР)
Индекс стабильности Ризнара (ИСР) является попыткой учесть эмпирические данные о наблюдаемой толщине отложений в городских водопроводных сетях. Также как и индекс Ланжелье, ИСР основывается на учете концентрации растворенного вещества. Ризнар предлагает определять соотношение между растворимостью карбоната кальция и образованием накипи. Индекс Ризнара рассчитывается по уравнению:
где pHCaCО3 — значение активности ионов водорода в насыщенном растворе карбоната кальция; pHизм. — измеряемая активность ионов водорода в анализируемой воде. Выводы из оценки ИСР по уравнению (17):
3.2.2. Индекс Паккориуса для оценки способности воды к накипеобразованию (ИНП)
Некоторые методики расчетов коррозионно-накипных индексов не учитывают два критических параметра: буферную емкость воды и максимальное количество осадка, которое может образовывать природная вода в равновесных условиях. Индекс накипеобразующей способности Паккориуса позволяет измерить соотношение между насыщенным состоянием и накипеобразованием, учитывая буферную емкость воды.
Вода, богатая кальцием, но с низкой общей щелочностью (ОЩ) и низкой буферной емкостью, может иметь высокую растворимость кальцита. Концентрация кальция растет с ростом произведения активности ионов. Зависимость произведения активности ионов от количества выпадающего из воды осадка сопровождается ощутимым снижением рН по мере как осаждения кальция, так и по мере снижения буферной емкости раствора.
где pHCaCО3 — значение активности ионов водорода в насыщенном растворе карбоната кальция; рНэкв. — равновесная активность ионов водорода: рНэкв. = 1,465 × lg(Alk) + 4,54, где Alk — общая щелочность:
Alk = [HCO3 – ] +2 × [CO3 2– ] + [OH– ]
(квадратные скобки — символ равновесной концентрации).
3.2.3. Индекс Ларсона-Скольда (ИЛС)
Индекс Ларсона-Скольда (ИЛС) [5] характеризует коррозионную способность воды по отношению к низкоуглеродистой стали и стальным образцам. ИЛС разработан на основе многолетних наблюдений коррозии трубопровода из низкоуглеродистой стали, по которому транспортируется вода Великих Озер (на границе США и Канады).
Индекс Ларсона-Скольда представляет собой отношение суммы эквивалентных концентраций хлорионов (Cl – ) и сульфат-ионов (SO4 2– ) к сумме эквивалентных концентраций гидрокарбонат-ионов и карбонат-ионов: ИЛС = (CCl – + CSO4 2–) /(CHCO3 2– + CCO3 2–). (19) ИЛС устанавливает причинную взаимосвязь между обычными скоростями коррозии и резкими повышениями ее скорости, которые наблюдаются в воде Великих Озер.
Экстраполяция этих данных на воды других источников, как с низкой, так и с крайне высокой щелочностью, неправомочна. ИЛС — испытанный полезный инструмент в предсказании коррозионной агрессивности охлаждающей воды в водооборотных циклах. Учитывая огромные объемы воды Великих Озер, используемой для охлаждения, особый интерес ИЛС представляет в случае применения ингибиторов коррозии, механизм действия которых основан на использовании естественной щелочности и пленкообразующей способности охлаждающей воды. ИЛС интерпретируется следующим образом способом:
3.2.4. Индекс Стиффа-Девиса (ИСД)
Индекс Стиффа-Дэвиса [6] является попыткой преодолеть недостатки индекса Ланжелье в случаях, когда концентрация солей жесткости в воде высокая и эффекта «общего иона» оказывает влияние на движущую силу образования отложений. Подобно ИЛС, ИСД базируется на концепции растворимости. Произведение растворимости, используемое для расчетов рН насыщенного раствора (pHS), эмпирически преобразовано в ИСД. ИСД показывает более низкую способность воды к образованию накипи, чем индекс Ланжелье в тех же условиях и при том же составе воды. Разница между показаниями индексов возрастает по мере роста ионной силы раствора. Интерпретация ИСД проводится по той же самой шкале, что и при расчетах индекса Ланжелье.
3.2.5. Индекс Оддо-Томсона (ИОТ)
Индекс Оддо-Томсона [7] позволяет оценивать влияние импульсных давлений и парциального давления СО2 на pH воды и растворимость карбоната кальция. Эта эмпирическая модель также учитывает поправки на присутствие двух или трех фаз (вода, газ, и нефть). Интерпретация индекса ведется по той же шкале, что и в ИЛС и ИСД.
4. Упрощенный расчет индекса Ланжелье
Как уже было отмечено ранее, расчет индекса Ланжелье достаточно сложен для не специалиста. Вполне естественно, что попытки упростить его предпринимались неоднократно. Отметим, что значения коэффициентов активности однои двухзарядных ионов, а затем и ионной силы раствора, определяются только их зарядом и концентрацией, но не химическими свойствами. Уместно напомнить, что мыобсуждаем варианты расчета для очень слабого раствора, в котором коэффициенты активности близки к единице.
Например, верхний предел применимости уравнения (2) ограничен концентрацией карбоната кальция 8,5 мг-экв/л или приблизительно 0,04%. В 2%-м растворе соляной кислоты, в 5%-м растворе серной и азотной кислот активность воды порядка 0,98. В 2%-м растворе карбоната натрия активность воды порядка 0,99, а карбоната калия—0,995. Поскольку индекс Ланжелье скорее качественный, чем количественный показатель, задачу расчета можно существенно упростить.
Можно заменить расчет ионной силы и коэффициентов активности ионов различного заряда измерением массы «сухого остатка», то есть общей массы всех солей, остающихся в пробе раствора после выпаривания. В этом случае не надо делать полный количественный химический анализ пробы воды. Достаточно просто высушить определенный объем воды и измерить взвешиванием массу осадка. Более того, массу растворенных в единице объема веществ легко и быстро можно установить с помощью уравнений (1) или (2) по электропроводности раствора, как это описано в разделе 2.1.
Следующий шаг на пути облегчения расчета индекса Ланжелье позволяет сделать и анализ математической модели, полученной регрессионным анализом. На базе экспериментальных данных о значениях индекса Ланжелье построена математическая модель в зависимости от следующих параметров: рН раствора; температуры t, при которой ведется измерение рН; общей щелочности Alk (см. табл. 2, «С.О.К.» №6/2005); концентрации иона кальция; массы растворенных в единице объема веществ — сухого остатка SR после выпаривания.
ILng = (–8,19 + 0,088 × Alk – – 4,69 × 10–8 × SR2) + 0,118 × Ca2+/pH + + (1,15 – 0,138/Ca2+ – 1,18/ t) × pH. (20)
Коэффициент множественной корреляции R2 = 0,997; среднеквадратичное отклонение расчетного значения индекса Ланжелье по модели (20) составляет s = ±0,04. Общая щелочность Alk и кальциевая жесткость Са2+ выражены в мг-экв/л, сухой остаток (SR) после выпаривания пробы воды выражен в мг/л. Температура измеряется в °С. Уравнение адекватно в следующих диапазонах изменения переменных:
А = (–8,19 + 0,088 × Alk – 4,69 × 10–8 × SR2);
B = (1,15 – 0,138/Ca2+ – 1,18/t);
D = 0,188 × Ca2+.
Оценка численных значений слагаемого D/рН показывает, что они меняются в диапазоне 0,1–0,5, составляя по всему набору данных в среднем 0,3. Еще меньше изменяется тангенс угла наклона B уравнения (21). Его численное значение меняется в диапазоне 1,06–1,10 при изменении температур измерения рН от 15 до 35°С, составляя по всему набору данных в среднем 1,08.
Поскольку индекс Ланжелье является качественной характеристикой свойств воды, мы можем считать D/рН постоянной величиной, равной 0,3, а коэффициент В— константой, равной 1,08. За счет этого уравнение для вычисления индекса Ланжелье становится еще проще, а для оценки коррозионно-накипных свойств воды нам достаточно выполнить только три измерения: общей щелочности Alk, сухого остатка SR после выпаривания пробы воды и рНизм. :
ILng = (–7,89 + 0,088 × Alk – 4,69 × 10–8 × SR2) + 1,08 × pH. (22)
Вспомним, что оценить содержание cухого остатка (SR) в воде позволяет уравнение (2) (см. раздел 2.1) по результатам измерения электропроводности воды. Таким образом, для оценки индекса Ланжелье — способности воды вызывать коррозию или образовывать накипь — требуется два инструментальных измерения: рН и электропроводности, а также выполнение только одного химического анализа общей щелочности Alk.
5. Оценка накипеобразующей способности воды
Основное вещество, образующее кристаллические осадки на трубопроводах, теплообменных поверхностях котлов и бойлеров, — карбонат кальция, практически всегда содержащийся в воде природных источников. Такая вода— наиболее дешевый и доступный теплоноситель. Поэтому в дальнейшем мыбудем говорить именно о кристаллизации карбоната кальция.
Для карбоната кальция характерна обратная зависимость растворимости от температуры. Это означает, что с ростом температуры растворимость карбоната кальция SCaCO3 не растет, как у большинства солей, а снижается. Поскольку наиболее высокая температура наблюдается на теплообменной поверхности, именно в приповерхностном слое самое высокое пересыщение и самая высокая скорость образования и роста кристаллов карбоната кальция. Рассчитать растворимость карбоната кальция в воде SCaCO3 с точностью ±1,5 мг/л в диапазоне температур 20–200°C позволяет уравнение, ранее опубликованное в [4]:
SCaCO3 = [6,723 × t × exp(–0,05064 × t)]0,5, (23)
где t — температура, °С. По сути это уравнение (12), в котором концентрация выражена в мг-экв/л. Движущей силой процесса кристаллизации является пересыщение SS, то есть превышение фактической концентрации растворенного вещества — в данном случае карбоната кальция — над его растворимостью:
где CCaCO3 — фактическая концентрация карбоната кальция в растворе, мг/л. Ранее при вычислении индекса Ланжелье мыиспользовали измерение массысухого вещества SR, содержащегося в единице объема воды. Эта величина представляет собой сумму концентраций карбоната кальция, обеспечивающего насыщение раствора по данной соли при данной температуре, и остальных растворенных солей. Поскольку нас интересует только карбонат кальция, его долю в общей массе растворенных сухих веществ позволяет учесть соотношение:
в котором все концентрации выражены в мг/л. Пересыщение по карбонату кальция в воде, в которой растворены различные соли, можно оценить по уравнению, которое получается в результате подстановки в уравнение (24) уравнений (23) и (25):
SS = [DCaCO3 × SR] / [SCaCO3 (t)] = [DCaCO3 × SR] / [6,723 × t × exp(–0,05064 × t)]0,5. (26)
Известно, что при росте температуры объем воды увеличивается, следовательно концентрация как масса растворенного, отнесенная к объему, снижается. Однако этот факт становится ощутимым только при высоких температурах. Так, например, если при 100°С объем воды увеличивается по сравнению с номинальным при 0°С на 4,3%, то при 250°С он больше уже на 26%.
Поскольку уравнение (23) позволяет рассчитывать концентрацию карбоната кальция до 200°С, есть смысл при расчете пересыщения в уравнение (26) внести коэффициент увеличения относительного объема воды с ростом температуры. Приведенное ниже уравнение получено на основе справочных данных, и представляет собой температурную зависимость отношения объема воды Vt0 при 0°С к объему воды Vti при i-той температуре:
Vt0/Vti = 1,028 – 8,330 × 10–4 × t, R2 = 0,9969; s = ±0,014. (27)
Уравнение (27) справедливо в диапазоне температур от 0 до 250°С. После подстановки его в уравнение (26) появляется возможность вычислять пересыщение по карбонату кальция с учетом температуры, до которой нагрета вода:
SS(t) = (1,028 – 8,330 × 10–4 × t)× DCaCO3 × SR/ [6,723 × t × exp(–0,05064 × t)]0,5. (28)
Напомним, что концентрацию сухих веществ в воде в мг/л позволяет вычислить уравнение (1) по данным об электропроводности.
Таким образом, пересыщение по карбонату кальция может быть вычислено по данным двух инструментальных измерений: электропроводности и температуры воды в зоне кристаллизации.
5.1. Оценка толщины слоя накипи
Попытаемся оценить толщину слоя накипи по данным о пересыщении и температуре воды на теплообменной поверхности или поверхности трубопровода. Лимитирующей стадией процесса кристаллизации является зародышеобразование. Если кристаллический зародыш образовался, то при наличии пересыщения до конечных размеров он растет достаточно быстро. Из теории кристаллизации следует, что частота гетерогенного зародышеобразования Iget (количество кристаллических зародышей, образующихся на единице поверхности в единицу времени) описывается уравнением [8].
где Kget — частота образования кристаллических зародышей на единице поверхности в единицу времени при бесконечно большом пересыщении SS.
где М — молекулярная масса кристаллизующегося вещества; NA — число Авогадро, т.е. количество молекул в одной граммолекуле; ρS — удельный вес (плотность) кристаллизующегося вещества; k — постоянная Больцмана; Т — температура в градусах Кельвина; σ— поверхностное натяжение на границе кристаллический зародыш/твердая поверхность; f (Θ)— функция угла смачивания твердой поверхности кристаллическим зародышем. Для дальнейших вычислений удобнее будет переписать уравнение (30) в следующем виде, выведя температуру из константы в переменную величину:
где B = (16 ×π)/3 × [M/(ρS × NA)]2 × ×(σ/k)3 × f (Θ). (33)
По данным наблюдений за толщиной слоя накипи, которая отложится за месяц на теплообменной поверхности, используя форму ее зависимости от пересыщения и температуры, предсказанную теорией, из уравнения (32) определим известными приемами (линеаризация и метод наименьших квадратов) [9] численные значения коэффициентов Kget, В:
d = 172 × exp[–8,57 × 109/(273 + t)3 × 1/ ln2(SS)]. (34)
Зная величину пересыщения (28) и температуру t на поверхности, возможно вычислить толщину слоя накипи, которая может отложиться за один месяц. Данная оценка может оказаться завышенной. Дело в том, что скорость образования накипи в значительной мере определяется материалом поверхности и ее состоянием. Как было показано в [4], на стали карбонат кальция в принципе не должен образовывать отложения, т.к. кристаллографическое несоответствие его кристаллов к кристаллам стали слишком велико.
Но как только на поверхности образуется гематит или сидерит (оксид железа, карбонат железа), на этом слое сразу же начинается кристаллизация карбоната кальция. Вот почему питательную воду котлов рекомендуют дегазировать — освобождать от растворенного кислорода и двуокиси углерода. Кроме того, как только на поверхности откладывается даже небольшой слой накипи, теплопередача в этом месте существенно ухудшается и, как следствие, падает температура, снижается пересыщение.
Другими словами, скорость отложений во времени в принципе не может быть постоянной величиной. Это следует все из тех же уравнений (28) и (34). Кроме того, как было показано в статье [4], скорость кристаллизации на поверхности зависит от термодинамического состояния раствора. Поскольку учесть все факторы, определяющие скорость кристаллизации и их взаимовлияние, практически невозможно, предлагается уравнение (34) рассматривать как оценочное, качественное.
Так же, как и индекс Ланжелье. Если по уравнению (34) построить графики толщины отложившегося за месяц слоя накипи при различных температурах и исходных концентрациях карбоната кальция в воде, то мы получим набор кривых. Как следует из уравнений (28) и (34), температура очень неоднозначно влияет на процесс накипеобразования. Повышение температуры снижает растворимость карбоната кальция, увеличивая пересыщение по этой соли, но одновременно увеличивается объем раствора и тем самым снижается концентрация.
Температура очень сильно (в третьей степени) влияет на скорость образования и роста кристаллов. Что касается исходной концентрации карбоната кальция в воде, то она, как следует из уравнений (26) и (34), нелинейно влияет на скорость отложений. Учитывая все это, мы попытались обобщить результаты вычислений по уравнению (34), «проиграв» все возможные варианты и построив по ним регрессионную модель:
D = –1,1 + 0,001 × SS × × [0,142 × t – 4,83 × 10–3 × SS + 560 × SS/C0 2 ]. (35)
Размерность толщины слоя накипи d, как и в уравнении (34), —мм/мес, SS — пересыщение, C0 = CCaCO3 = D × SR — исходная концентрация карбоната кальция в воде при комнатной температуре. Таким образом, сделать прогноз о толщине отложений, которые могут образоваться на поверхности за месяц, можно всего лишь измерениями температуры поверхности и электропроводности при комнатной температуре омывающей ее воды.
Для наглядности кривые толщины слоя накипи, откладывающейся на теплообменной поверхности за месяц, при C0 = 0,5 мг/л или 1,5 мг-экв/л, показаны на рис. 2. Таким образом, в главе 4 и 5 автор предлагает дальнейшее усовершенствование индекса Ланжелье и метод прогнозирования толщины образующегося слоя накипи в зависимости от пересыщения и температуры. Диагностика никогда не лечит, но указывает путь к выздоровлению.
Чтобы избавиться от коррозии и одновременно не спровоцировать образование накипи, необходимо индекс Ланжелье, как следует из рис. 1, поддерживать близким к нулю, т.е. в диапазоне от –0,4 до +0,4. Как следует из уравнения (22), при условии ILng = 0 это возможно, если:
pH = 7,306 – 0,0815 × Alk + + 4,343 × 10–8 × SR2. (36)
В широком диапазоне значений общей щелочности Alk и содержания сухих веществ SR в пробе воды после выпаривания близкое к нулю значение индекса Ланжелье обеспечивается при рН = 6,95–7,05. Практические рекомендации очевидны: если рН больше 7,05, воду необходимо подкислить, если рН ниже 6,95, воду надо подщелачивать. Почти такой же результат обеспечивает удаление растворенных веществ (SR = 0) или общей щелочности (Alk = 0).
Напомним, что как правило общая щелочность совпадает с карбонатной жесткостью воды. Что касается снижения способности воды к накипеобразованию, то, как следует из уравнений (34) и (35), надо принимать меры по снижению пересыщения до 1. То есть концентрацию карбоната кальция в воде снижать до уровня растворимости при данной температуре.