известно что в плазме крови концентрация раствора
Известно что в плазме крови концентрация раствора
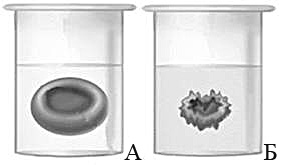
Известно, что концентрация солей в плазме крови соответствует концентрации 0,9% хлорида натрия в физиологическом растворе. В стеклянный стакан, заполненный раствором поваренной соли, поместили эритроциты. Сравните изображения нормального эритроцита в плазме (рис. А) и эритроцита в растворе (рис. Б). Объясните наблюдаемое явление. Определите концентрацию соли в стакане (0,9%, более 0,9%, менее 0,9%).
Известно, что в растительных клетках присутствуют два вида хлорофилла: хлорофилл a и хлорофилл b. Учёному, для изучения их структуры, необходимо разделить эти два пигмента. Какой метод он должен использовать для их разделения? На чём основан этот метод?
Анализа результатов нарушения сцепленного наследования генов позволяет определить последовательность расположения генов в хромосоме и составить генетические карты. Результаты многочисленных скрещиваний мух дрозофил показали, что частота нарушения сцепления между генами А и В составляет 5%, между генами А и С — 11%, между генами С и В — 6%. Перерисуйте предложенную схему фрагмента хромосомы на лист ответа, отметьте на ней взаимное расположение генов А, В, С и укажите расстояние между ними. Какая величина принята за единицу расстояния между генами?
1. эритроцит в растворе сморщился из-за потери воды;
2. вода по закону диффузии (осмоса) поступила из эритроцита в раствор;
3. концентрация раствора соли в стакане — более 0,9%.
Целесообразно применить метод хроматографии. Метод основан на разной скорости движения веществ смеси через адсорбент в зависимости от их молекулярной массы.
2) за единицу расстояния между генами принят 1% кроссинговера, эта величина названа морганидой.
Известно что в плазме крови концентрация раствора
Данный материал взят из книги “Диагностические тест-системы: Радиоиммунный и иммуноферментный методы диагностики” Таранова Анатолия Григорьевича и размещен на сайте с любезного разрешения автора.
ТЕХНИКА ЛАБОРАТОРНЫХ РАБОТ
2.1. Условия взятия и хранения биологического материала
Подготовка к проведению лабораторных исследований содержит два основных момента: необходимость соблюдения стандартных условий взятия биологического материала и предотвращение деградации биологически активного вещества в образцах.
3) множество лекарственных веществ способны влиять на определяемые вещества, повышая или понижая их уровень в крови;
4) взятие исследуемого образца у пациентов в горизонтальном, в вертикальном положении или после физической нагрузки изменяет уровень биологически активных веществ иногда более чем на 10 %.
Желательно, чтобы кровь, предназначенная для исследования, забиралась в однотипные центрифужные пробирки. Такие пробирки должен готовить (мыть, высушивать, добавлять коагулянт или ингибитор ферментов) один сотрудник. Кровь без добавок отстаивают, а с добавками центрифугируют, полученную сыворотку или плазму разливают в такое количество мелких пластмассовых или стеклянных пробирок (стекло не всегда выдерживает низкую температуру), которое равно или превышает число разных типов тестирования.
Во время процедуры взятия крови следует избегать гемолиза, который некоторым возможен при длительном венозном застое, энергичной аспирации крови шприцем, попадании в просвет иглы воды и детергентов, действии на кровь высокой и низкой температур.
2.1.1. Получение сыворотки или плазмы крови
Цельная кровь (капиллярная и венозная) используется в основном в биохимических исследованиях (определение глюкозы, показателей КЩР, определение концентрации электролитов в эритроцитах) и гематологии (исследование LE-клеток, гематокрита, на малярию, проведение стандартного клинического анализа крови). Для радиоиммуиных и иммуноферментных методов получают сыворотку или плазму.
При выборе вида материала следует учитывать следующее:
1) При получении сыворотки крови возникает опасность того, что при отстаивании крови из эритроцитов интенсивно освобождаются протеолитические ферменты, которые могут разрушить определяемое вещество и повредить его меченый аналог во время инкубирования. Поэтому для определения содержания белковых соединений предпочтительно готовить плазму крови.
2) При получении плазмы часто используют гепарин или цитрат. Первый блокирует связывание антитела с антигеном, второй существенно изменяет кислотность среды, к которой чрезвычайно чувствительны некоторые вещества. Поэтому в сухую центрифужную пробирку желательно насыпать 50 мг ЭДТА на 5 мл крови (1:100). Сразу же после забора кровь перемешать с ЭДТА и отцентрифугировать. ЭДТА является слабым антикоагулянтом, блокатором протеолитических ферментов и составной частью многих буферных смесей.
2.1.2. Обработка крови для лабораторных исследований
Полученная и доставленная в лабораторию кровь должна быть быстро обработана, или подвергнута исследованию. Длительное стояние сыворотки над эритроцитами может привести к сдвигам концентраций составляющих, поэтому время стояния сыворотки над сгустком должно быть ограничено. Кроме того, биологический полураспад некоторых исследуемых веществ настолько мал, что стояние сыворотки при высокой комнатной температуре может полностью исказить полученные результаты исследования.
Полученную сыворотку (плазму) необходимо быстро отделить от форменных элементов крови и плотно закрыть пробирки крышкой. Если получена липемическая или гемолизированная сыворотка, образец, как правило, выбрасывается.
2.1.3. Хранение крови (плазмы, сыворотки)
Для определения большинства биологического материала считается возможным хранение его при комнатной температуре не более 6-8 часов.
При работе с кровью общим правилом должно являться немедленное отделение плазмы или сыворотки от форменных элементов, так как некоторые вещества могут поглощаться и инактивироваться эритроцитами и лейкоцитами. Но даже в простых водных растворах они спонтанно окисляются (например, кортизол превращается в 21-дезоксикортизол).
Образцы крови необходимо хранить в хорошо закрытых пробирках, так как потеря в образце влаги в замороженном состоянии может привести к концентрированию исследуемого вещества и получению в итоге ошибочного результата.
По экономическим соображениям важно до госпитализации и до любых терапевтических вмешательств взять образцы плазмы или сыворотки и поместить их в банк сывороток. После установления диагноза, если нет нужды в исследовании биологического материала, и образец не нужен для исследований, он может быть изъят из банка сывороток или плазм, однако, в наличия патологического процесса (особенно опухоли) возможно повторное определение уровня исследуемых веществ или их комбинаций. Кроме того, исследуемый образец рекомендуется оставлять в банке сывороток с тем, чтобы при модификации наборов фирмой-поставщиком, можно было корректно продолжить мониторинг больного. Этот подход также может оказаться полезным, если появится новый маркер, отличающийся более высокой чувствительностью и специфичностью.
Размораживание и повторное замораживание повреждает практически все биологические пробы. Существует ошибочное мнение о том, что такое воздействие не влияет на тиреоидные и стероидные гормоны. Действительно, структура молекул этих гормонов лучше сохраняется в таких ситуациях. Однако следует помнить, что основной пул стероидных и тиреоидных гормонов циркулирует под “защитой” транспортных белков, которые, как и все другие белки, не выдерживают температурных перепадов и, разрушаясь, перестают “защищать” гормоны. Последние, освобождаясь, немедленно включаются в метаболическую цепь, что, в конечном итоге, ведет к искажению истинной картины.
Химическое окружение, в котором находится препарат, также является важным фактором. При хранении белков в растворах концентрация этих белков всегда должна быть больше 1 мг/мл. Известно, например, что разбавленная антисыворотка теряет активность намного быстрее, чем неразбавленная. Молекулы некоторых веществ биологического происхождения особенно легко разрушаются при окислении, поэтому их надо хранить в присутствии какого-нибудь восстановителя или в атмосфере, не содержащей кислорода.
Учитывая высокую скорость разрушения биологически активных веществ в органах и тканях, извлечение их и приготовление навесок анализа необходимо проводить в условиях постоянного охлаждения, хранить образцы только в замороженном состоянии. Предварительная обработка материала позволяет значительно увеличить его срок хранения. Например, после обработки гипофиза ацетоном первоначальный уровень гонадотропной активности сохраняется в нем при хранении в холодильнике без замораживания не менее года. Экстракты гормонов и чистые препараты сохраняются гораздо дольше, чем нативные образцы.
Известно, например, что в тканях гипоталамуса рилизинг-фактор к лютеинизирующему гормону подвергается сравнительно быстрому метаболическому разрушению. В то же время при хранении в стерильных условиях растворов синтетического ЛГ-рилизинг-гормонов в течение 18 месяцев при 40 °С он полностью сохранял свою биологическую активность и иммунореактивные свойства.
2.1.4. Получение, обработка и хранение мочи
Сбор мочи для определения биологически активных веществ проводят в течении заданных интервалов времени, чаще всего за сутки. На протяжении суток скорость образования и экскреции вещества с мочой колеблется весьма значительно, но эти колебания нивелируются при исследовании суточной порции мочи. В последнее время появляется возможность определять не в суммарной суточной моче и не суммарные вещества, а конкретные вещества и в любое время суток. Например, определение андрогена надпочечникового происхождения дегидроэпиандростерона-сульфата, или 17-окси-прегненолона, предназначенного для выявления адреногенитального синдрома.
Из рациона человека, по меньшей мере, за трое суток до сбора мочи
необходимо исключить продукты и лекарственные препараты, влияющие на
секрецию и метаболизм ряда веществ. Присутствие в моче некоторых
веществ эндогенного и экзогенного происхождения может искажать
результаты определения веществ. Сбор мочи производят в сосуды из дифферентного материала (стекла, пластмассы) во избежание разрушения вещества.
При сборе мочи также соблюдают определенные предосторожности, ли моча не содержит стабилизаторов, как, например, при определении стероидов и их метаболитов, она должна храниться до анализа в замороженном виде (как правило, не более 10 дней). Замороженную мочу со стабилизатором, предназначенную для определения катехоламинов, допускается хранить не более трех дней.
2.1.5. Получение экссудатов и транссудатов
Перед сбором экссудатов и транссудатов в посуду для сбора рекомендуется добавить 2 капли гепарина или на кончике ножа сухого цитрата натрия для предотвращения свертывания. Жидкость собирается в чистую сухую посуду и немедленно доставляется в лабораторию.
2.1.6. Сбор и хранение кала
Для исключения возможных погрешностей в диагностике запрещено доставлять кал после использования клизм, введения свечей, приема внутрь касторового и вазелинового масел и красящих веществ. Кал, взятый для исследования на дисбактериоз, должен быть срочно доставлен в лабораторию, или поставлен в холодильник при 4°С. При исследовании на простейшие запрещено сохранять кал в термостате или теплой воде, поскольку при этом происходит гибель и регенеративные изменения простейших.
2.1.7. Сбор и хранение мокроты
Мокроту рекомендуется собирать при кашле в сухую чистую посуду не более суток, так как при длительном хранении происходит разложение флоры и аутолиз элементов мокроты. Кратковременное хранение ее рекомендуется проводить в холодильнике при 4°С. Для бактериологических исследований мокрота не должна стоять более 4 часов с момента получения.
2.1.8. Сбор и хранение ликвора
Спинномозговая жидкость (ликвор), полученная при люмбальной пункции или пункции желудочков мозга, собирается в сухую чистую посуду и доставляется в лабораторию немедленно, так как при хранении в связи с разрушением клеточных элементов результат исследования может быть недостоверным.
2.2. Обработка лабораторной посуды
В специальных пособиях приводится много советов по тех лабораторных работ, поэтому мы ограничимся лишь некоторыми рекомендациями, имеющими существенное значение для постановки реакции и получения высококачественного результата в радиоиммунных и иммуноферментных методах диагностики. При работе с буферными системами, органическими растворителями и другими веществами, применяемыми для постановки реакции, особое внимание нужно обращать на чистоту реактивов. Вода для буферного раствора должна быть бидистиллированной и деионизированной. Органические растворители, как правило, подлежат очистке (например, эфир пропускается через колонку с оксидом алюминия) и двойной перегонке с дефлегматором (напр., при получении абсолютного этанола).
Лабораторная посуда должна быть тщательно обрабатывается механическими и химическими способами.
Приготовление моющего раствора:
на 1 л дистиллированной воды 20 г порошка типа «Лотос».
Приготовление хромовой смеси:
в фарфоровом стакане растворяют 50 г бихромата калия (K 2 Cr 2 O 7 ) в 100 мл воды. Раствор сливают в сосуд большего размера и добавляют (очень осторожно) 1 л серной кислоты (концентрированной).
Внимание! Добавлять серную кислоту в раствор, но не наоборот!
2.2.1. Обработка посуды с низкой радиоактивностью
2.2.2. Обработка посуды с высокой радиоактивностью
Все вышеописанные работы проводить только в вытяжном шкафу при полном отсутствии открытого огня.
Для выполнения биохимических исследований в лаборатории посуда проходит определенный цикл обработки в соответствии с требованиями санитарно-гигиенических и противоэпидемических служб. При выполнении в лабораториях коагулологических исследований или проведения исследований определения ряда пептидных гормонов биологическими методами помимо обычной чистой стеклянной посуды используют силиконированную посуду для взятия и хранения крови и плазмы.
2.2.3. Силиконирование посуды
Силиконирование посуды осуществляют для предотвращения контаминации исследуемого образца со стеклом, в котором проводят химическую реакцию. Силиконирование тормозит активацию свертывания крови, предохраняя распад некоторых веществ (например, пептидных гормонов) при инкубации их со встряхиванием.
Стекло покрывается мономолекулярной пленкой силикона:
5% раствор дихлордиметилсилана в толуоле. Чистая сухая посуда заполняется раствором и сразу же выливается. Силиконирование проводят в вытяжном шкафу, затем проводят сушку посуды в сушильном шкафу 180°С в течение часа.
Раствор для силиконирования хранят в посуде с притертой пробкой
в вытяжном шкафу.
Использовать силиконированную посуду не более 5 раз, затем силиконирование необходимо повторить.
Известно что в плазме крови концентрация раствора
Известно, что в плазме крови концентрация солей в норме соответствует концентрации хлорида натрия 0,9%. В стеклянный стакан, заполненный раствором поваренной соли, поместили эритроциты. Сравните изображение нормального эритроцита в плазме (рис. А) и эритроцита в растворе (рис. Б). Объясните наблюдаемое явление. Определите концентрацию соли в стакане с раствором (более 0,9%, менее 0,9%, равна 0,9%).
Данную задачу проверяют не автоматически, а вручную. Ознакомьтесь с критериями оценки, правильным решением и сами себе поставьте оценку от 0 до 2 баллов. Даже если вы ошиблись в цифровом ответе, можно получить несколько баллов за правильный ход решения. Форма для оценки находится внизу страницы.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
|---|---|
| Элементы ответа: 1) эритроцит в растворе сморщился из-за потери воды, которая по закону диффузии (осмоса) поступила из эритроцита в раствор; 2) концентрация раствора соли в стакане – более 0,9% | |
| Ответ включает в себя все названные выше элементы, не содержит биологических ошибок | 2 |
| Ответ включает в себя один из названных выше элементов и не содержит биологических ошибок, ИЛИ ответ включает в себя два названных выше элемента, но содержит биологические ошибки | 1 |
| Все иные ситуации, не соответствующие правилам выставления 2 и 1 балла. ИЛИ Ответ неправильный | 0 |
| Максимальный балл | 2 |
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| 2 | |
| Ответ включает в себя все названные выше элементы, не содержит биологических ошибок | |
| Ответ включает в себя один из названных выше элементов и не содержит биологических ошибок, ИЛИ ответ включает в себя два названных выше элемента, но содержит биологические ошибки | 1 |
| Все иные ситуации, не соответствующие правилам выставления 2 и 1 балла. ИЛИ Ответ неправильный | 0 |
| Максимальный балл | 2 |
Элементы ответа:
1) эритроцит в растворе сморщился из-за потери воды, которая по закону диффузии (осмоса) поступила из эритроцита в раствор;
2) концентрация раствора соли в стакане – более 0,9%