Штамм чумы что это
Что такое чума? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Чума («чёрный мор», «чёрная смерть») — острое заболевание, вызываемое бактерией Yersinia pestis. Относится к группе особо опасных карантинных инфекций. Клинически характеризуется синдромом общей инфекционной интоксикации, лихорадкой, поражением лимфоузлов, ретикулоэндотелиальной системы (тканей, богатых макрофагами, например микроглии), лёгких и других тканей человека. Передаётся различными путями, из которых наиболее опасен воздушно-капельный. Без адекватного лечения чума может привести к смерти. Описаны случаи применения в качестве биологического оружия: в летописях XIV, XVIII века и японцами в 1939 и 1942 гг.
Этиология
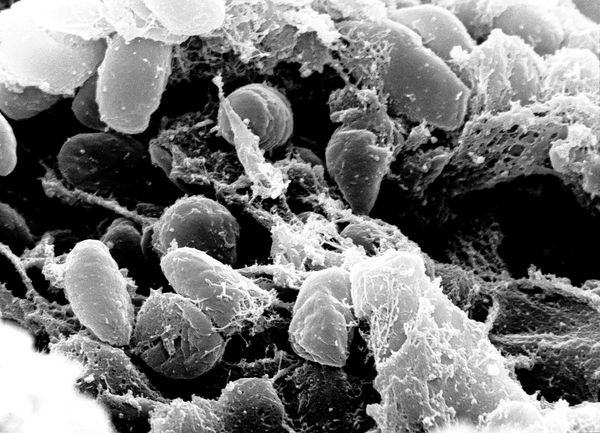
Возбудитель чумы — чумная палочка (Yersinia pestis), открытая в июне 1894 года в Гонконге французом Александром Йерсеном и японцем Китасато Сибасабуро. Выявлено, что чумной микроб возник при мутации бактерии псевдотуберкулёза (Y. Pseudotuberculosis) не более 20 000 лет назад. Впервые чумные эпидемии описаны в летописях древнего мира, упоминаются в Библии.
Вид: Yersinia pestis (чумная палочка)
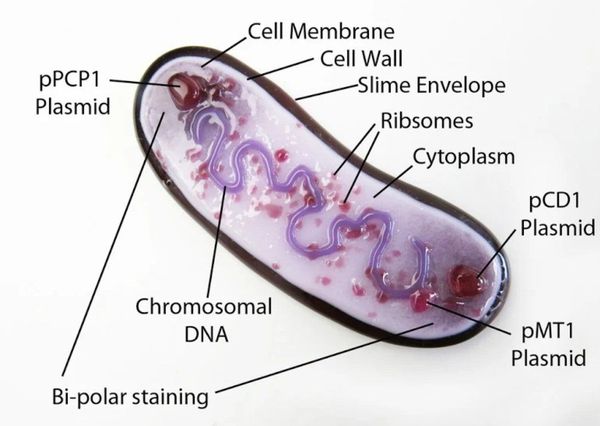
Y. pestis — неподвижная грамотрицательная палочка размером 0,3-0,6 × 1-2 мкм, округлой, нитевидной или удлинённой формы. Покрыта капсулой из слизистого вещества, окрашивается биполярно: интенсивно на концах и бледнее в центре. Не имеет жгутиков и не образует спор. Факультативный внутриклеточный анаэроб — способна развиваться как в клетках, так и за их пределами.
Факторы патогенности (вещества, определяющие способность бактерии вызывать инфекционный процесс):
Y. pestis умеет расщеплять углеводы и вырабатывает ферменты, помогающие заселять организм: гиалуронидазу, коагулазу, гемолизин, фибринолизин, пестицин. Существует несколько подвидов возбудителя чумы, различных по способности заражать организм.
Бактерии растут на обычных питательных средах с добавлением гемолизированной крови или сульфита натрия для стимуляции роста при температуре 28-30°С, рН среды 7,0-7,2 с видимым результатом через 12-14 ч.
Содержит более 30 антигенов, V- и W-антигены подавляют иммунные реакции, в частности фагоцитоз. Капсула защищает микроорганизм от растворения полиморфно-ядерными лейкоцитами, контролирующими различные стадии воспаления.
Чумная палочка сохраняется в выделениях больных людей и на объектах внешней среды:
Выдерживает низкие температуры: при 0 °С сохраняется шесть месяцев, в замороженных трупах — год и более. Не переносит:
Эпидемиология
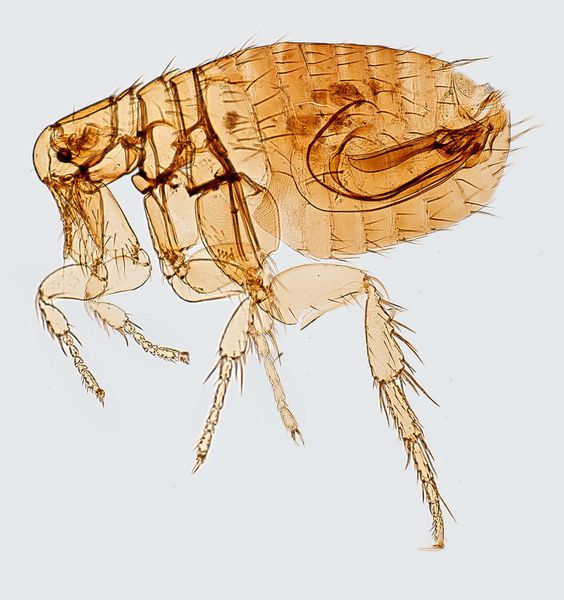
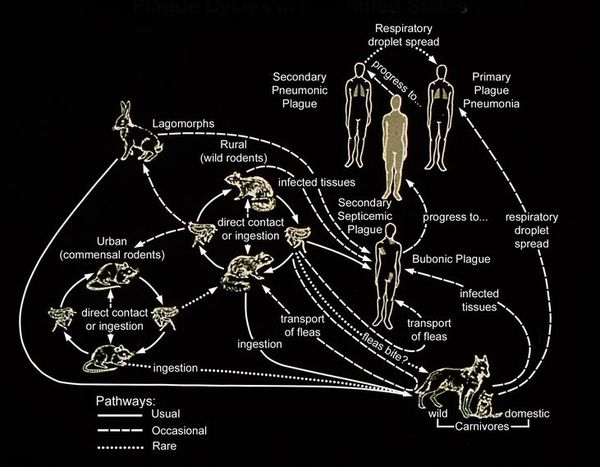
Резервуар и основной источник инфекции — грызуны. Реже болеют зайцы, кролики, лисы и верблюды. Ранее эпидемии чумы вызывали миграции крыс, заражающихся в природных очагах. Переносчики чумы — крысиные блохи (Xenopsylla cheopis).
Распространённость чумы
В XXI веке эпидемии чумы не возникают, выявляют лишь единичные случаи:
Основные природные очаги в РФ:
Механизмы передачи:
Человеческая форма чумы редко поражает животных. Заболевание, как правило, проходит в лёгкой форме. Подозреваться заражение можно, если появился кашель с кровью и в скором времени животное погибло.
Симптомы чумы
Инкубационный период при заражении от укуса блохи и контакта с инфицированным материалом длится от 3 до 6 дней. При аэрогенном заражении лёгочной формой — 1-2 дня. У привитых пациентов этот период растягивается до 12 дней. Прививка действует около года, обеспечивая относительную защиту. Затем, в течение непродолжительного времени, болезнь развивается в более лёгкой форме, по окончанию периода — как у непривитых.
Чума часто протекает в среднетяжёлой и тяжёлой форме. Болезнь начинается остро, внезапно. Симптомы заболевания:
С развитием болезни возбуждение сменяется апатией и адинамией, появляется сыпь на коже, выраженная тахикардия, нарушение ритма сердца, прогрессирующее падение артериального давления. Развивается учащённое поверхностное дыхание (тахипноэ), снижается количество отделяемой мочи вплоть до анурии.
Выделяют четыре клинические формы чумы: кожную, бубонную, первично-септическую, лёгочную.
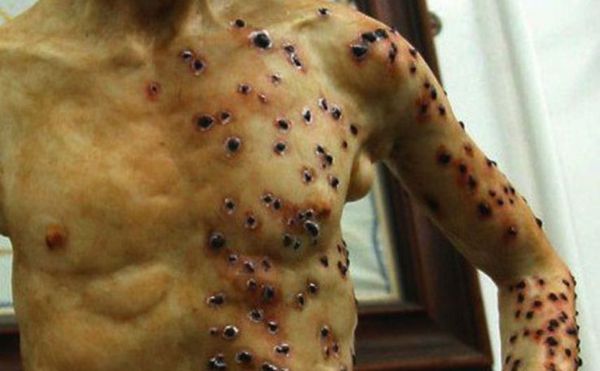
Кожная форма чумы
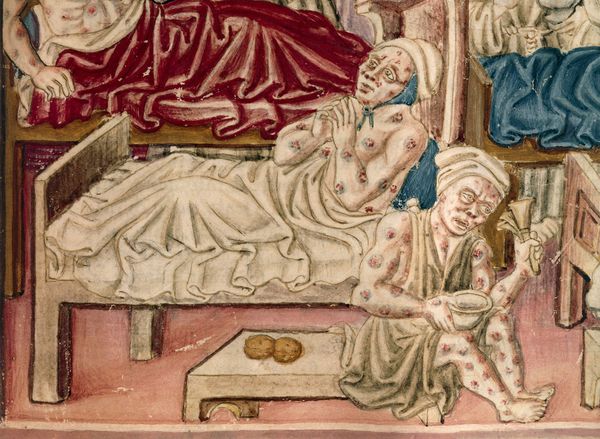
На коже последовательно формируются: пятно, папула, пузырёк, гнойный пузырёк (пустула) с конечным превращением в язву. Пустула болезненна, наполнена гнойно-кровавым содержимым, окружена зоной воспаления и находится посреди плотного багрово-красного основания. При разрыве возникает язва с дном тёмного цвета. После выздоровления в этой области формируется рубец. При своевременной антибиотикотерапии смертность не превышает 1 %.
Бубонная чума
Для бубонной формы чумы характерно появление и развитие бубона — болезненного лимфоузла (или группы лимфоузлов), расположенного в любой зоне, чаще в паху. Бубон плотный на ощупь с нечёткими неровными контурами, спаян с подкожной жировой клетчаткой и ограничивает движение конечностей. Кожа в этой области сухая, горячая на ощупь, с течением болезни приобретает багрово-синюшный оттенок. При развитии заболевания бубоны размягчаются, нагнаиваются, появляются гнойные свищи. Возможно распространение инфекции и возникновение вторичных бубонов в других областях. Вокруг поражённых лимфоузлов развиваются вторичные пузырьки с кровянистой жидкостью (фликтены чумы). При своевременном лечении смертность не более 5 %. При отсутствии терапии летальность — 90 %.
Первично-септическая форма
Лёгочная форма
Чума при беременности
Патогенез чумы
Иммунная система человека практически неспособна противостоять натиску чумной палочки. Это связано со стремительным размножением возбудителя, выработкой им факторов патогенности и антифагинов, подавляющих фагоцитоз (поглощение бактерий клетками иммунной системы) на начальных этапах, и слабым образованием антител.
Входные ворота при кожно-бубонной форме — кожа в месте укуса или втирания фекалий блох в повреждённую кожу, конъюнктивы, слизистые оболочки ротоглотки. При лёгочной форме чумы — слизистые оболочки респираторного тракта.
Этапы развития заболевания:
При попадании возбудителя в ткань лёгких (20 % случаев) возникает вторично-лёгочная форма заболевания. Стремительно развивается гангренозно-геморрагическая пневмония, увеличиваются и воспаляются трахеобронхиальные лимфоузлы, в плевральной полости скапливается жидкость (плевральный выпот).
Классификация и стадии развития чумы
Классификация и стадии развития
2. По клинической форме:
3. По степени тяжести:
Без лечения болезнь часто протекает в тяжёлой форме и заканчивается смертью.
Осложнения чумы
Диагностика чумы
Все действия с потенциально инфицированными материалами при подозрении на чуму проводятся в специализированной лаборатории особо опасных инфекций, работающей с патогенами I класса биологической опасности (в западных странах IV класса).
Лабораторная диагностика:
Дифференциальная диагностика:
2. Лёгочная чума (в т.ч. септическое течение):
3. Кожная форма чумы:
Лечение чумы
Независимо от формы болезни, необходима строгая изоляция пациента в инфекционном отделении больницы или ОРИТ (отделение реанимации и интенсивной терапии) боксового типа.
Режим — палатный, постельный или полупостельный. Диета — №2 или №7 по Певзнеру с ограничением поступления ионов натрия и контролем уровня потребляемой жидкости.
Антибиотикотерапию необходимо начать сразу, не дожидаясь лабораторного подтверждения диагноза. Даже при лёгочной форме чумы в первые 12-15 часов болезни есть шансы на выздоровление. Назначаются препараты:
Длительность введения антибиотиков — не менее 10 дней или до двух дней после исчезновения лихорадки.
Параллельно проводится применяют сорбенты и противоаллергические препараты. Для улучшения состояния ЖКТ принимают пищеварительные ферменты и пробиотики.
Критерии выздоровления при чуме:
Прогноз. Профилактика
Прогноз благоприятный, если начать лечение лёгкой и среднетяжёлой формы чумы своевременно. При развитии тяжёлой формы, особенно лёгочной чумы, пациент часто погибают.
Меры профилактики:
Смертельный поцелуй чумы
Смертельный поцелуй чумы
Фрагмент картины Ханса Бальдунга «Смерть и девушка».
Автор
Редактор
Статья на конкурс «био/мол/текст»: Возбудитель чумы как самая опасная бактерия в мире продолжает создавать угрозу безопасности мировому сообществу. Что делает его столь смертоносным? В статье рассмотрены основные причины уникальной патогенности чумного микроба на уровне биомолекул и их систем, а также обозначена перспектива поиска новых маркеров вирулентности.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Один монах, странствуя по белому свету, встретил Чуму, которая направлялась в его город.
— Ты куда это направляешься, Чума? — спросил он ее.
— Иду в твой родной город, — ответила она. — Мне нужно забрать там тысячу жизней.
Через некоторое время монах снова встретил Чуму на своем пути.
— Почему ты меня обманула тогда? — спросил он ее с укором. — Ты говорила, что должна забрать тысячу жизней, а забрала пять тысяч.
— Я тогда сказала тебе правду, — ответила Чума. — Я действительно забрала тысячу жизней. Остальные умерли от страха.
Жертвы чумы исчислялись сотнями тысяч и даже миллионами человек, вымирали города, становились безлюдными целые области, и ужас пандемий чумы затмевал ужасы всех войн, какие знала история человечества. Целые тысячелетия люди не понимали, что является источником заболевания [2].
Библия — одно из древнейших дошедших до нас свидетельств эпидемий чумы (1 книга Царств, глава 5; 4 книга Царств, глава 19, стихи 35–36). В мировой истории отмечают три пандемии этой болезни:
Крупные вспышки чумы регистрируют с определенной периодичностью (Индия — 1994 г.; Мадагаскар — 2011 и 2013 гг.). В США с 1965 по настоящее время ежегодно регистрируют до 40 случаев заражения людей чумой (в среднем 10 больных в год) [5]. В России в сентябре 2014 г. и в августе 2015 г. впервые за последние 35 лет были зарегистрированы два случая заражения человека чумой [6], [7].
В природе чумной микроб встречается практически на всех континентах, исключая Австралию, Антарктиду, а также Арктику, что обусловливает ежегодно регистрируемые случаи этой болезни. Стремительная эволюция микроорганизмов приводит к появлению популяций бактерий (штаммов), устойчивых к антибиотикам [9], что в случае с возбудителем чумы особенно опасно. Кроме того, этих бактерий могут использовать в качестве агента биотерроризма. Все вышесказанное объясняет необходимость изучения чумного микроба.
Возбудитель чумы Yersinia pestis — самая опасная бактерия в мире [10]. Что делает ее столь смертоносной?
Факторы вирулентности, или вооружен и очень опасен
Любые патогенные бактерии должны обладать целым рядом свойств: «способностями» к инвазии (внедрению), колонизации, противостоянию иммунным реакциям организма хозяина и токсичностью. Биомолекулы, осуществляющие эти функции, называются факторами патогенности (вирулентности).
Со времен открытия возбудителя чумы в 1894 году французом Александром Йерсеном и японцем Китасато Сибасабуро ученые пытались выяснить, что определяет патогенность Y. рestis. В результате многолетней тяжелой и рискованной работы, которая продолжается и по сей день, выделили следующие факторы патогенности возбудителя:
Белки внешней мембраны, или зачем возбудителю чумы шприц?
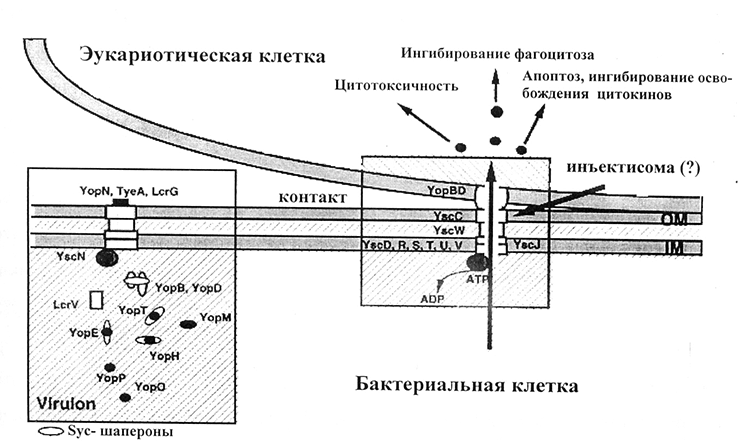
Изучение отдельных Yop-белков, а именно V- и W-антигенов, началось еще в 1956 году [16]. Описаны также YopM, YopN, YopH, YopE, YopD и другие белки [17]. Они подавляют развитие иммунных реакций, в частности, фагоцитоз, а при «заглатывании» микробов макрофагами (иммунными клетками) обеспечивают размножение возбудителя внутри макрофагов [11]. Белки внешней мембраны синтезируются только при температуре 37 °С и в условиях дефицита ионов кальция (low calcium response) [18]. Механизм действия Yop-белков — система секреции III типа — открыт в конце прошлого века [19]. Согласно этому механизму, чумной микроб, приблизившись к эукариотической клетке, впрыскивает эффекторные белки в цитоплазму (по принципу работы шприца с образованием особого канала — «иглы») (рис. 1) [20]. Особое внимание ученые уделяют V-антигену, так как на его основе создают химическую вакцину против чумы [21].
Рисунок 1. Схема действия системы секреции III типа.
Комплекс области пигментации, или может ли стать потребность в чем-либо фактором патогенности?
В ходе лабораторных работ исследователи установили, что чумной микроб может стать авирулентным (безопасным) для мышей. При высеве таких бактерий на питательные среды с гемином (железосодержащим веществом, образующимся при действии соляной кислоты на гемоглобин) они образуют неокрашенные колонии, в отличие от пигментированных колоний вирулентных штаммов. Так появился один из простейших способов определения вирулентности штаммов возбудителя чумы без использования лабораторных животных. Если популяция бактерий на среде с гемином (среде Джексона—Берроуза) «дает» рост пигментированным колониям, то она является опасной (вирулентной), если непигментированным — то не опасной (авирулентной) [22].
Активатор плазминогена, или двуликий Янус
Большое внимание уделяют омптинам — семейству протеаз наружных мембран, которые выполняют множество функций в бактериальной клетке, в том числе перенос различных веществ через внешнюю мембрану, и, в целом, способствуют адаптации микроорганизма к условиям окружающей среды. Один из них — активатор плазминогена (Pla) [25]. Еще до выделения Pla, специалисты приходили к противоречивым, на первый взгляд, выводам. С одной стороны, чумной микроб сворачивает плазму крови (плазмокоагулирующая активность), с другой стороны — предотвращает образование кровяного сгустка (фибринолитическая активность). Тем более удивительно, что обеими этими активностями, как впоследствии выяснилось, обладает один и тот же белок — активатор плазминогена. Оказалось, что при температуре ниже 30 °С Pla проявляет плазмокоагулирующую активность. В преджелудке зараженной блохи (переносчика чумных микробов) сворачивается кровь, поступившая из больного чумой грызуна, и образуется «блок» — резервуар для размножения иерсиний. При этом голодная блоха начинает активно кусать животное или человека, не чувствуя насыщения. При поступлении свежей порции крови возбудитель с «отрыжкой» блохи проникает в ранку и инфицирует ее. Попадая в другую среду с температурой 36–37 °С — температурой тела человека (или немного выше — теплокровного животного), — активатор плазминогена начинает действовать в прямо противоположном направлении: проявляет фибринолитическую активность — препятствует образованию кровяного сгустка в месте укуса и тем самым обеспечивает распространение возбудителя [26].
При вдыхании чумных микробов (и развитии легочной чумы) этот белок обеспечивает быстрое размножение бактерий в тканях легких и приводит к развитию молниеносной пневмонии и отеку легких, тогда как в отсутствии Pla инфекция не развивается в смертельную пневмонию. Установлено, что активатор плазминогена нарушает постоянство внутренней среды организма хозяина и блокирует иммунные реакции, направленные на уничтожение патогена [27].
Капсульный антиген, или скользкий тип этот возбудитель чумы
Бактерии окружены капсулой из слизистого вещества (фракция I, Fra1), которая препятствует поглощению и обезвреживанию Y. pestis иммунными клетками организма-хозяина в процессе фагоцитоза. На выявлении этого вещества-антигена основаны многие современные методы лабораторной диагностики чумы, оно входит в состав многих экспериментальных химических вакцин против чумы. Однако позднее обнаружили популяции бактерий, лишенные капсулы [28]. Кроме того, слизистая капсула есть у многих других микроорганизмов, например, возбудителя сибирской язвы, туляремии. Капсульное вещество иерсинии образуют при температуре 37 °С.
Пили адгезии (pH6-антиген), или «агент 007»
Специфический антиген pН6 (пили адгезии — мелкие ворсинки, белок PsaA) также синтезируется только при температуре 37 °С, но есть и еще одно условие — pН ниже 6,4 (что нашло отражение в его названии). Cчитается, что это значение рН близко к рН лизосом макрофагов или некротического содержимого абсцессов, где, вероятно, и синтезируется этот антиген. рН6-антиген ответственен за прикрепление чумных микробов к эпителиальным клеткам дыхательных путей и колонизацию их. Этот антиген интересен еще и тем, что подавляет фагоцитоз: при попадании иерсиний в кровь, pH6-антигены соединяются с аполипопротеинами В плазмы, что делает бактериальные клетки «невидимыми» для макрофагов [29]. Следовательно, в изначально агрессивном теплокровном организме хозяина популяции чумного микроба с рН6-антигеном имеют больше шансов на выживание, чем популяции возбудителя чумы без рН6-антигена — феномен селекции PsaA+ бактерий [30]. В природных очагах чумы выделяют только штаммы Y. pestis с рН6-антигеном.
Антигены, схожие с рН6, были обнаружены у ряда возбудителей, вызывающих менее опасные болезни — кишечные инфекции (Y. pseudotuberculosis [31], Y. enterocolitica [32], Escherichia coli [8]).
Температурный фактор, или то, что действительно имеет значение
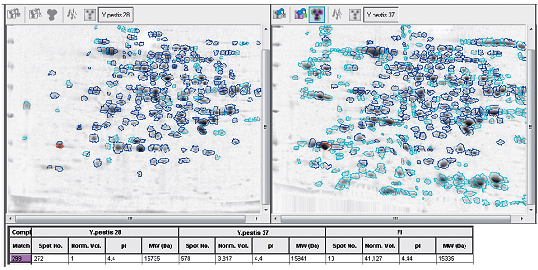
Необходимо заострить внимание на особой роли температуры в физиологии чумного микроба. Именно при температуре 37 °С у него повышаются питательные потребности [33] и синтезируются практически все известные детерминанты вирулентности (рис. 2) [34]. У других бактерий подобная зависимость выражена в меньшей степени, что позволяет говорить о ведущей роли температурного фактора в вирулентности возбудителя чумы [8].
Рисунок 2. «Белковые портреты» чумного микроба, выращенного при температурах 28 и 37 °С соответственно.
Геном или все важное внутри
О секвенировании генома иерсиний, вызвавших «черную смерть» 1340 года, читайте в материале «Это чума» [3]. — Ред.
Помимо хромосомы у чумного микроба есть плазмиды — внехромосомные участки ДНК [38]. Большинство белковых факторов вирулентности закодированы на плазмидах: эффекторные белки на плазмиде pCad; капсула — pFra; активатор плазминогена — рPla (pPst, pPCP). Плазмиды pFra и рPla обнаружены только у Y. pestis (видоспецифические), pCad является общей с возбудителем псевдотуберкулеза (родоспецифическая) [20].
Заключение
Несмотря на успехи, достигнутые в изучении чумного микроба, вопрос о ведущих факторах вирулентности его возбудителя остается открытым. Так отмечена «неодинаковая агрессивность» штаммов Y. pestis, обладающих одинаковым набором известных факторов патогенности [8].
В настоящее время продолжается работа по выявлению новых, еще не изученных маркеров вирулентности [39]. С использованием 2D-электрофореза, масс-спектрометрии, полногеномного секвенирования проводят сравнительный анализ отличающихся по вирулентности популяций чумного микроба для выявления различий в их белковых спектрах и геномных последовательностях. Ранее не известные белки и участки генома становятся объектом пристального внимания и изучения как потенциальные детерминанты вирулентности.
Таким образом, патогенность возбудителя чумы — это множественный (полидетерминантный) признак. Соединение многих факторов в единое целое создает страшную угрозу чумных эпидемий, с противостоянием которым, однако, прогрессивное человечество успешно справляется.
Происхождение чумы: экологический сценарий
К 120-летию открытия А. Йерсеном и Ш. Китазато микроба чумы Yersinia pestis
Об авторе
Виктор Васильевич Сунцов — доктор биологических наук, ведущий научный сотрудник Института проблем экологии и эволюции им. А. Н. Северцова РАН. Занимается изучением происхождения и эволюции возбудителей природноочаговых инфекций, в частности чумы.
Диаграмма публикаций по проблеме чумы, фиксирующая скачок их числа с 2003 г.
Немного истории
Первые упоминания о чуме (или чумоподобной инфекции) известны из Первой книги Царств Библии, где говорится о «вселенском море», охватившем население ближневосточных городов Азот, Геф, Аскалон, Ашдод, Вефсамис во время войны филистимлян с израильтянами в 1200 г. до н. э. Болезнь сопровождалась тотальным падежем «мышей» и появлением на теле больных людей «наростов» (бубонов). С той далекой поры и до наших дней загадка происхождения чумы занимает прогрессивные умы человечества. История насчитывает сотни чумных эпидемий и эпидемических вспышек [1]. Но относительно полные сведения имеются лишь о двух последних пандемиях. Первая из них, «черная смерть», выйдя из глубин Центральной Азии, охватила нижнее Поволжье, Причерноморье, Ближний Восток, Европу, в Северной Африке распространилась по Средиземноморью и оттуда по долине Нила углубилась к югу континента до Килиманджаро. Последняя началась в конце XIХ в. в Гонконге, откуда корабельные крысы разнесли чуму по всему миру и она охватила более 80 морских портовых городов. В Африке и в Новом Свете с домовыми грызунами возбудитель проник в глубь континентов, где внедрился в природу и обосновался в виде устойчивых вторичных природных очагов [2, 3].
Карта распространения чумы в Европе. Пандемия, начавшаяся в центральных районах Азии, достигла берегов Черного моря в 1347 г.
Целители и врачеватели с глубокой древности задумывались над секретами неожиданного, словно «из-под земли», возникновения чумных эпидемий в разных странах и на разных континентах, но понять причины этого явления стало возможным только благодаря созданию теории природной очаговости чумы. Для этого науке об инфекциях понадобилось пройти исторический путь длиной более столетия.
Пандемия «черная смерть». Чума бубонной формы
Начало действительно научному подходу к познанию чумы положили 120 лет назад А. Йерсен и Ш. Китазато. В 1894 г. в Гонконге в начале третьей пандемии они открыли возбудителя этой инфекции — микроб Bacteria pestis (позднее — Pasteurella pestis, а с 1967 г. — Yersinia pestis), доказав тем самым микробную этиологию болезни. В 1906 г. Английская комиссия, созданная для выяснения причин пандемии в колониальной Индии и разработки методов борьбы с ней, установила носительство чумного микроба синантропными грызунами (серой и черной крысами, домовой мышью, бенгальской и индийской бандикотами). Казалось бы, версия о чуме как исходной болезни синантропных крыс получила надежное обоснование. Но уже через несколько лет, в 1911 г., Д. К. Заболотный в Забайкалье выделил возбудителя чумы в популяциях дикого грызуна сурка тарбагана (Marmota sibirica), обитающего в малонаселенных степных и горно-степных ландшафтах Южной Сибири и Центральной Азии. В 1920–1930-х годах Ву Лиен-те, работая сначала в крысиных очагах многих стран мира, а затем в глубинах Центральной Азии, в удаленных от цивилизации очагах «тарбаганьей болезни», предположил, что она возникла именно в этих местах, причем очень давно [4]. Эта гипотеза, не обоснованная какими-либо весомыми аргументами, была широко поддержана во многих научных публикациях. В них авторы связывали древность возбудителя с филогенетической древностью сурков — первичных, по их представлениям, хозяев чумного микроба.

«Черная смерть». Гравюра П. Фюрста, 1656 г.
К середине XX в. был накоплен большой объем знаний по эпидемиологии, эпизоотологии, клинике болезни, ее распространению в мире, дано определение природного очага чумы и сформулированы, хотя и не бесспорно, основные положения теории. Ее фундамент стал закладываться Заболотным на основании сведений, полученных им при изучении маньчжурской вспышки в 1898 г., а к 1960-м годам теория приобрела вполне логичный вид. Чума предстала как древняя болезнь норовых грызунов, возникшая в олигоцене-миоцене-плиоцене в аридных районах Палеарктики (или Голарктики), передающаяся трансмиссивным путем с участием «блокированных» блох. Со временем возбудитель инфекции по межконтинентальным сухопутным мостам (берингийскому, синайскому и панамскому) попал на все континенты мира, исключая Австралию и Антарктиду. Однако сегодня эта версия о естественном проникновении возбудителя чумы в Новый Свет из Северной Азии мало популярна, а преобладает идея его антропогенной интродукции морским путем во время последней, третьей пандемии. В наши дни чумной микроб существует на четырех континентах в многочисленных природных очагах в популяциях более 200 видов диких норовых млекопитающих.
На основе этой господствующей гипотезы о месте и времени появления чумного микроба выстраивались и увязывались «классические» положения теории: медленное коэволюционное формирование микроба и среды его обитания — аридных ценозов Северного полушария (степей, горных степей, полупустынь, пустынь), с которыми связана эволюция сурков, сусликов, песчанок, пищух, полевок.
В последнюю четверть XX в., по мере появления новых экологических, палеоклиматических и других фактов, а также совершенствования молекулярных методов исследования, стало ощущаться несовершенство теории природной очаговости, накапливались и обострялись противоречия. Одно из них — толкование адаптивной сущности трансмиссивной передачи возбудителя блохой, у которой в просвете пищеварительного тракта образуется блок размножающимися бактериями. Парадокс состоит в том, что «блокированная» блоха живет всего несколько дней и умирает от голода. Такой механизм трансмиссии вряд ли можно считать эволюционно отточенным. Противоречия в теории множились быстро, и на рубеже XX и XXI вв. «красивая» теория природной очаговости чумы дала сбой. Принципиально новую идею относительно времени появления возбудителя выдвинула молекулярная генетика.
Когда появился микроб чумы?
Доказанное в 1980 г. молекулярными методами непосредственное родство псевдотуберкулезного (Y. pseudotuberculosis) и чумного (Y. pestis) микробов привело к выводу об их недавней дивергенции, правда, без указания времени и места, когда именно и где это случилось [5]. Высокое сходство их геномов позволяло некоторым авторам даже объединить их в один вид в качестве отдельных подвидов, хотя вызывают они совершенно разные болезни. И псевдотуберкулезного, и чумного микробов относят к семейству Enterobacteriaceae — возбудителям кишечных инфекций, но последний, будучи паразитом крови, не имеет к ним никакого отношения. У него иная адаптивная среда, и в принципе его нужно отнести к другому семейству [3].
Микрофотография чумной палочки. Увел. ×200. Фото с сайта cdc.gov
Идея недавнего отделения чумного микроба от псевдотуберкулезного была неожиданной, но отнюдь не новой. В 1950–1970-х годах такие мысли высказывали В. Н. Беклемишев, В. А. Бибикова, А. И. Дятлов, Л. Н. Классовский, В. С. Петров, Н. М. Хрусцелевская. Но тогда подобные интуитивные ощущения эволюционной молодости возбудителя чумы выглядели теоретически чуждыми, паранаучными и деструктивными, поэтому они не нашли поддержки у ортодоксов.
В 1999 г. М. Ахтман с соавторами опубликовали результаты своих генетических исследований [6]. После этой, можно сказать, революционной статьи в течение нескольких лет почти все работы о чумном микробе включали тезис: «возбудитель чумы Yersinia pestis произошел от возбудителя псевдотуберкулеза Y. pseudotuberculosis 20000–1500 лет назад», т. е. в конце позднего плейстоцена или голоцене. Точность такой датировки, рассчитанной методом «молекулярных часов», позволяла выстраивать дальнейшие экологические следствия. Указанный Ахтманом верхний временной предел происхождения чумного микроба (1500 лет назад) можно игнорировать, как и идею автора о зарождении микроба в земледельческих районах долины Нила в популяциях экзоантропной травяной мыши (Arvicanthis niloticus). Разносторонние факты надежно свидетельствуют об отсутствии какого-либо вмешательства человека в этот естественный процесс. Несомненно, это был дикий микроб. Нижний временной предел (20 тыс. лет назад) — конец позднего плейстоцена — более правдоподобен. Тогда, во время максимального похолодания в Северной и Восточной Азии, зона «вечной» мерзлоты продвинулась на юге до Гобийской пустыни. На территории Северной, Восточной и Центральной Азии этот период именуют сартанским временем (22–15 тыс. лет назад). Полагаю, что районом происхождения возбудителя чумы стала Центральная Азия — уникальная психроаридная область, где «вечная» мерзлота сомкнулась с пустыней, где холодно и сухо.
Вслед за статьей Ахтмана появилась публикация М. Скурника с соавторами, указывающая на непосредственного предка чумного микроба [7]. Им оказался сапрозоонозный психрофильный псевдотуберкулезный микроб 1-го (O:1b) серотипа, преобладающий в органике внешней среды (моче, экскрементах животных). В холодных районах Сибири, Дальнего Востока и Центральной Азии этот серотип вызывает у людей дальневосточную скарлатиноподобную лихорадку (ДСПЛ), которую еще называют болезнью из холодильника. Чаще ею заболевают люди, употребляющие немытые продукты (фрукты, овощи), хранившиеся в овощехранилищах и холодильниках, доступных грызунам. «Молекулярные часы» и ареал возбудителя ДСПЛ в обширном регионе азиатской «вечной мерзлоты» позволяют ориентировочно отнести время его возникновения к началу плейстоцена, когда в связи с всеобщим похолоданием на Земле началось обширное оледенение Северного Ледовитого океана [3, 6].
К концу XX в. набралось множество научных фактов, подтверждающих недавнее происхождение микроба чумы от возбудителя псевдотуберкулеза 1-го серотипа, и потому выводы Ахтмана и Скурника были подхвачены широким кругом исследователей. Итак, на вопрос «когда?» был получен вполне правдоподобный «молекулярно-генетический» ответ. А на вопросы «где?» и «как?» смогла ответить эволюционная экология (при поддержке других классических направлений естествознания).
Головокружение от успехов
К началу XXI в. выяснилось, что одно из основополагающих положений в теории природной очаговости чумы (филогенетическая древность возбудителя) ошибочно. Это подстегнуло научный ажиотаж, и среди ученых ведущих стран мира, включая Россию с ее полуразрушенной противочумной системой, началась настоящая гонка за приоритетом в раскрытии происхождения чумы как молодой инфекции. Возглавили эту гонку молекулярные генетики — такова сейчас «мода» эволюционной биологии.
В современных исторических реконструкциях в биологии доминирует новая филогенетика (молекулярная филогенетика, генофилетика). Отчасти это лидерство оправдано широкими возможностями, которые предоставляют молекулярные структуры и компьютерные технологии филогенетических построений, позволяющие сравнивать и обрабатывать миллионы признаков, — таких, как последовательности нуклеотидов. Все составляющие новой филогенетики полезны, они необходимы для создания естественных филогенетических схем, но недостаточны, особенно в отношении прокариот. Молекулярная генетика — молодая наука, и закономерности молекулярной эволюции пока не вполне ясны. Филогении можно выстраивать только по гомологичным признакам, а их выявление, в том числе и на молекулярном уровне, представляет немалую проблему. Выводы на основе применения разных молекулярно-генетических методов далеко не однозначны, порой не согласуются между собой и с данными других наук: экологии, биогеографии, микробиологии и др. Такая обескураживающая разноголосица свойственна и заключениям в отношении микроба чумы.
Успехи в изучении молекулярно-генетической структуры бактерий рода Yersinia и их диагностики несомненны. По специфическим молекулярным маркерам можно определить и охарактеризовать чумного микроба из любого природного или антропогенного очага (даже какой-либо отдельной его части), можно также дифференцировать множество его внутривидовых популяционных форм, приспособленных к какому-либо одному хозяину или к нескольким видам хозяев. Но генетические маркеры позволяют выявлять и ранжировать кластеры признаков и строить только древеса генов, отражающих эволюцию отдельных признаков или морфофункциональных систем (отдельные семофилезы). Однако выстраивать по отдельным маркерам-признакам цельные филогенезы — дело сомнительное, рискованное и ненадежное. Молекулярно-генетические различия позволяют судить о структуре внутривидового разнообразия, но не о его причинах и путях формирования. Таким образом, все молекулярно-генетические филограммы, сценарии происхождения и эволюции микроба чумы — лишь частные семофилезы, отдельные схемы преобразования каких-либо «удобных» признаков, не более чем «вариации на тему» происхождения возбудителя чумы. Филогенезы с экологической (адаптационной) точки зрения, — это множество комбинаторных, сложно взаимодействующих семофилезов. Филогения — история конкретной группы, и познается она только через ее результаты. Ими служат признаки и функции организмов, включая морфологические, поведенческие, физиологические, биохимические, молекулярно-генетические, а также отношение организмов к абиотическим и биотическим факторам среды, распространение в пространстве и времени и т. д. Значит, чтобы получить и проанализировать цельные совокупности таких комбинаций, нужны годы и годы напряженных кропотливых совместных классических и молекулярно-генетических исследований.
Сегодня в среде молекулярных генетиков популярна филогенетическая схема, в которой «полевковые» подвиды микроба чумы, циркулирующие в популяциях полевок (подсемейство Microtinae) и пищух (род Oсhotona), рассматриваются как наиболее древние примитивные формы, промежуточные между предковым псевдотуберкулезным и дочерним чумным микробами. Действительно, по ферментации сахаридов рамнозы (Rha+) и мелибиозы (Mlb+) и по некоторым другим признакам эти подвиды сходны с псевдотуберкулезным микробом [8]. Поэтому вопрос о происхождении чумы молекулярные генетики сейчас ставят примерно так: что именно не более 20 тыс. лет назад привело к преобразованию психрофильного сапрозоонозного псевдотуберкулезного микроба 1-го серотипа, циркулирующего в популяции(ях) полевок, в новый филум микроба чумы? Но с экологической точки зрения, ни постановка вопроса в такой форме, ни сама филогенетическая схема, ни прокламирование исторического приоритета полевковых подвидов не выдерживают элементарной критики.
Наиболее популярное в настоящее время филогенетическое древо, построенное на основе «удобных» молекулярных маркеров [8]. По данным молекулярной генетики, в его основании находятся наиболее древние «полевковые» подвиды (O.PE2, O.PE3, O.PE4). Названия биоваров микроба чумы: ANT — antiquа (древний); MED — mediaevalis (средневековый); ORI — orientalis (восточный); л. н. — лет назад
Сценарии происхождения, эволюции и распространения чумного микроба в мире, созданные на основе молекулярно-генетических филограмм, как правило, изобилуют субъективными домыслами и историческими фантазиями. В зависимости от выбранных генетических маркеров считается, что возбудитель мог возникнуть на Кавказе, либо в горах Памира, в Китае, или на Африканском континенте. Однако ни одна из версий не согласуется ни с известными «классическими» фактами, ни с молекулярно-генетическими данными.
Так, ареал псевдотуберкулезного микроба 1-го серотипа приурочен к холодным районам Северо-Центральной Азии и Дальнего Востока; значит, именно там логично искать истоки чумы. Известно также, что псевдотуберкулезный микроб способен синтезировать необходимые для метаболизма аминокислоты из неживой органики внешней среды; а «полевковые» подвиды чумного микроба по биохимическим показателям, в сравнении с «сурковыми», «сусликовыми», «песчанковыми», более зависят от организма хозяина, специализированы к нему и, соответственно, должны быть наиболее молодыми [9]. Кроме того, по генетическим признакам в «полевковые» подвиды объединены микробы, циркулирующие в популяциях полевок (отряд Rodentia) и пищух (отряд Lagomorpha), существенно отличающихся по физиологическим и биохимическим характеристикам! Наконец, псевдотуберкулезный микроб не передается здоровому грызуну напрямую от больного, чтобы стать инвазивным, он должен пребывать некоторое время в холодной внешней среде, т. е. заражение происходит только пищевым путем. Значит, переход свободноживущего псевдотуберкулезного микроба в организм теплокровных полевок за короткое в эволюционном масштабе время должен был совершиться скачкообразно из внешней среды (мочи, экскрементов) в кровь полевок, с температурой тела около 37°С. Для описания такого одноактного видообразования используют концепцию горизонтального переноса специфических плазмид чумного микроба pFra и pPst. Но, с одной стороны, такое одноактное видообразование в природе вполне справедливо ставится под сомнение последователями синтетической теории эволюции, с другой стороны, надежных случаев встраивания «экзогенов» в геном чумного микроба в естественных условиях не описано.
Колоссальные достижения в изучении геномов бактерий рода Yersinia и их диагностики вызвали в среде молекулярных генетиков «головокружение от успехов». Окрыленная триумфальными успехами молекулярная генетика, как всякое новое «модное» и быстро развивающееся направление, замахнулась единолично решить все проблемы построения филогенетического древа рода Yersinia. К великому сожалению, эти исследователи, воспринимая «классику» как отживший архаичный натурализм, сосредоточились на своих лабораторно-инструментальных подходах и методах. Несмотря на «агрессивную» экспансию в эволюционной биологии и амбициозные притязания молекулярных генетиков, единолично решить все проблемы происхождения чумы им не под силу. Генофилетика — не особый, успешный и всемогущий раздел филогенетики, а главным образом это источник определенного рода новых и перспективных данных. Новая молекулярная филогенетика, оперирующая этими данными, вместе с классической филогенетикой должны прийти к единому непротиворечивому толкованию любых фактов-признаков и их связей. Это и будет означать открытие эволюционного принципа, экологического и молекулярно-генетических механизмов происхождения и эволюции возбудителя чумы.
Происхождение Yersinia pestis: взгляд натуралиста
Отсутствие единого хорошо обоснованного подхода к пониманию истории чумы создает переизбыток молекулярно-генетической информации, привлекаемой порой невпопад для филогенетических построений. Выручила «классика», которая, казалось бы, уже исчерпала себя в этом вопросе. Прежде всего — экология, точнее экология монгольского сурка тарбагана и ее специфического паразита, блохи Oropsylla silantiewi. Этим объектам мы посвятили треть века наших исследований.
Знание экологии монгольского сурка и его блох позволяет понять селективные (адаптационные) процессы, проходившие в микробных популяциях в природе, и причинно-следственные связи в эволюционных филумах. Появление возбудителя чумы в Центральной Азии предопределили два природных фактора: аридность горно-степных ландшафтов, постепенно увеличивающаяся с олигоцена-миоцена, и максимальное похолодание в сартанское время последнего оледенения. Проще говоря, индуктором видообразования микроба чумы был сухой и холодный климат Центральной Азии в конце ледниковой эпохи. Кроме того, в возникновении чумного микроба важную роль играет физиология, точнее поведение монгольского сурка, связанное с устройством зимовочной пробки, а также особенности сурочьей блохи O. silantiewi.
Участники паразитарной системы: блоха Oropsylla silantiewi и монгольский сурок. Фото с сайта bbc.voc.com.cn
В Центральной Азии, в горно-степных поселениях сурка тарбагана влажность почвы очень низкая, всего 2–7% [3], а грунт в зимовочной норе зверька сухой и щебнистый. Изготовить из него земляную пробку внутри норы, в вертикальном лазе диаметром 15–20 см, все равно, что замазать сухим песком отверстие в потолке размером с футбольный мяч. Из-за дефицита почвенной влаги у монгольского сурка выработалось специфичное поведение. При залегании в спячку он устраивает зимовочную пробку из специально подготавливаемой смеси мелкозема, щебня и влажных каловых масс, которые летом собираются в отнорках (уборных). Для перетаскивания камней, обвалянных в фекалиях, сурки используют зубы, при этом частицы фекалий, а с ними и возбудитель псевдотуберкулеза, попадают в ротовую полость. Итак, во рту спящих тарбаганов — экскременты, а в них — кишечный паразит, микроб псевдотуберкулеза!
Монгольский сурок тарбаган и его зимовочная (постоянная) нора. Вверху: зимовочная пробка, состоящая из смеси мелкозема, щебня и цементирующих их экскрементов (1); гнездовая камера (2); отнорки-уборные, в которых в летние месяцы сурки накапливают строительную смесь (3). Внизу: слой мелкозема и щебня (а); и коренные породы (б), приведены температуры грунта и спящих сурков во время раскопки (февраль 1979 г.)
Сурки — типичные семейно-колониальные животные. Группировки из 2–22 разновозрастных и разнополых зверьков совместно зимуют в одной постоянной, или зимовочной, норе. У каждого зверька в течение зимней спячки более длительные периоды глубокого сна (торпора) чередуются с короткими периодами бодрствования (эутермии). В торпорной фазе температура тела снижается до 2–5°C, в эутермной может достигать нормальной, у активных сурков — около 37°С. За осенне-зимне-весеннее время сурки не вполне синхронно просыпаются до 15 раз, примерно дважды в месяц. Таким образом, каждый зверек в течение периода подземной жизни имеет два гомеостатических состояния, между которыми лежит промежуток физиологической гетеротермии. Отсюда следствие: блохи в холодное время года питаются на сурках, температура тела которых лежит в диапазоне 5–37°C. Обратим внимание на непрерывность температур!
В 1970-х годах в тувинском очаге чумы, расположенном в Центральной Азии, мы изучали зимнюю спячку тарбагана. В феврале-марте, во время максимального зимнего промерзания грунта (до глубины более 2 м), раскопали три зимовочных норы. Из них изъяли восемь глубоко спящих и девять проснувшихся активных зверьков, среди которых были молодые, полувзрослые и взрослые особи. Из их шерсти собрали 230 личинок O. silantiewi, 60 живых и 452 пустых коконов, а из ротовой полости торпидных зверьков — дополнительно 20 личинок. Пустые коконы (от 4 до 87) обнаружили также на 22 зверьках, отловленных в первые две недели после весеннего пробуждения.
Тувинский природный очаг чумы, Монгун-Тайгинский мезоочаг. Снеговое покрытие в зимне-весенние месяцы не превышает 30–40%, грунт промерзает на глубину более 2 м к началу января, а оттаивает в июле
Отметим распределение коконов на шерсти: большая часть прикреплена на голове, у основания хвоста и на наружной стороне задних ног. Все личинки, извлеченные из ротовой полости, оказались с кровью и увеличенными в размерах за счет развития жирового тела, что свидетельствовало о полноценности пищи и об их готовности к окукливанию. У спящих зверьков поврежденная личинками слизистая ротовой полости и язык обильно кровоточили, изо рта заметно выступала кровяная пена, а рот, зубы, лапы были обильно испачканы экскрементами (следами устройства зимовочной пробки осенью). Незарубцевавшиеся раны в ротовой полости мы наблюдали у всех сурков, отловленных после выхода из нор в конце марта и начале апреля, что говорит о массовости описываемого явления, его общепопуляционном характере.
Подведем итог наших наблюдений. С осени в ротовую полость тарбаганов попадают экскременты и, соответственно, псевдотуберкулезный микроб. Слизистая ротовой полости, поврежденная зимой личинками блох, постоянно кровоточит из-за временной (торпорной) гемофилии. В ротовой полости происходит постоянное «заражение крови» возбудителем псевдотуберкулеза. У сурка во время глубокого сна подавлена активность иммунной защиты; его «холодная» кровь, как органическая среда обитания псевдотуберкулезного микроба, уподобляется экскрементам. Есть убедительные основания полагать, что факультативная личиночная гематофагия специфических блох сурков зародилась относительно недавно, и характерна она для холодных и бесснежных районов Центральной Азии.
На основе новых эколого-географических, палеоклиматических и генетических данных можно сформулировать основные постулаты теории происхождения и мировой экспансии микроба чумы.
Происхождение, естественное распространение в Евразии и антропогенная мировая экспансия микроба Y. pestis во время первой (I), второй (II) и третьей (III) пандемий. 1 — южная граница зоны многолетнемерзлых грунтов; 2 — граница доминантного распространения в природе микроба Y. pseudotuberculosis O:1b; 3 — ареал сурка-тарбагана, район происхождения микроба чумы; 4 — первичные природные очаги; 5 — вторичные природные очаги; gly + (gly − ) — способность (неспособность) штаммов ферментировать глицерин
Предковая форма возбудителя чумы — микроб псевдотуберкулеза 1-го серотипа (Y. pseudotuberculosis O:1b), который доминирует в северо-центрально-азиатских и дальневосточных районах с суровым климатом.
Метаморфоза микроба псевдотуберкулеза в чумную бактерию произошла в конце позднего плейстоцена. За весь четвертичный период глубокое промерзание грунта (2 м и более) в Центральной Азии отмечено только в сартанское время позднего плейстоцена и в голоцене, т. е. не ранее 22 тыс. лет назад [10].
В ультраконтинентальном районе зимнего антициклона в Центральной Азии личинки блох, паразитирующие на монгольском сурке тарбагане, зимой переходят к факультативной гематофагии, что приводит к устойчивому контакту крови сурков с псевдотуберкулезным микробом [3].
Теперь уже можно легко представить, как сапрозоонозный кишечный псевдотуберкулезный микроб постепенно эволюционировал в облигатный паразит крови незимоспящих грызунов: экскременты тарбагана → спящий сурок → активный сурок → незимоспящий грызун.
Знание молекулярно-генетических, популяционных и биоценотических факторов, а также их многообразных связей позволяет выделить в эволюционной истории возбудителя чумы основные вехи.
I. Возбудитель чумы появился в паразитарной системе «монгольский сурок M. sibirica — блоха O. silantiewi» во время максимального четвертичного (сартанского) похолодания в позднем плейстоцене в Центральной Азии.
II. В голоцене чумной микроб естественным путем по принципу «масляного пятна» распространился в популяциях норовых грызунов и пищух на аридных пространствах Евразии.
III. Во время татаро-монгольской экспансии на запад, создавшей условия для второй пандемии, микроб «суркового» подвида (antiqua) вырвался за пределы естественного азиатского ареала, антропогенным путем распространился по Европе и проник на африканский континент, где образовал вторичные природные очаги в популяциях местных песчанок Gerbillurus и Taterillus.
IV. Во время третьей пандемии с корабельными крысами микроб уже другого подвида (orientalis) из Азии вновь проник в Африку и впервые на быстроходных морских судах добрался до Нового Света, где закрепился в виде вторичных природных очагов в популяциях земляных белок, луговых собачек, полевок, морских свинок.
Таким образом, в Евразии встречается множество подвидов микроба чумы [11], на африканском континенте — два подвида («сурковый» и «крысиный»), в Новом Свете — только один («крысиный»).
В поисках согласия
Экологический сценарий происхождения, эволюции и мировой экспансии возбудителя чумы весьма заметно расходится с гипотезами, построенными на основе генетических данных. Где же истина? Какой из них достоин большего одобрения?
В пользу экологического сценария говорит следующее:
Такие аргументы делают этот экологический сценарий наиболее правдоподобным в сравнении с другими, позволяют принять его за исходную гипотезу и наполнять его генетическими признаками. Биологическое содержание сценария, понятное широкому кругу исследователей, дает существенные гносеологические преимущества перед слишком редуцированными историческими реконструкциями. К примеру, некоторые авторы из-за сходства отдельных генетических признаков у кавказского подвида Y. pestis caucasica и псевдотуберкулезного микроба считают Кавказ родиной чумы и выстраивают соответствующую филограмму [11, 12]. Но на Кавказе, в относительно теплом климатическом регионе, нет псевдотуберкулезного микроба 1-го серотипа или он встречается крайне редко! Истоки чумы следует искать в холодных, суровых краях — как в предложенном сценарии.
Несмотря на разительное несходство экологической и генетической филогений, между ними нет непреодолимой пропасти, более того, есть безусловные точки соприкосновения. Экологический сценарий для молекулярных и генетических признаков очерчивает диапазон генетической изменчивости микробной популяции, вступившей на путь видообразования, выделяет рамки экологической достоверности генетических фактов, привлекаемых для филогенетических выводов [3, 13].
Как показывает экологический сценарий, успех молекулярной реконструкции истории чумного микроба придет с пониманием сущности трех тезисов: первый — микробы псевдотуберкулеза Y. pseudotuberculosis O:1b и чумы Y. pestis tarbagani имеют прямые родственные отношения, но не сходны (по клиническим проявлениям и показателям вирулентности и патогенности). Второй — микроб псевдотуберкулеза Y. pseudotuberculosis O:1b и микробы чумы «полевковых» и «пищуховых» подвидов Y. pestis caucasica, altaica, hissarica, ulegeica, microtus сходны по вирулентности и патогенности, отдельным биохимическим и генетическим признакам, но не имеют прямых родственных связей. Третий — за родством не всегда следует сходство, и, наоборот, из сходства не всегда следует родство; параллельная эволюция распространена широко, поэтому любые признаки для построения филогений (не только молекулярные) следует подбирать тщательно и крайне осторожно, опираясь на весь ранее накопленный всесторонний научный багаж.
Сейчас филогенетический анализ молекулярно-генетических данных ориентирован на сценарии-гипотезы, отражающие два разных классификационных подхода. В западных научных школах филогению чумного микроба «примеряют» к внутривидовой классификации Девинья [14], в которой выделено три внутривидовых формы (биовара): древняя, или сурковая, — antiqua; средневековая, или песчанковая, — mediaevalis и восточная, или крысиная, — orientalis. Недавно китайские исследователи добавили четвертую, полевковую, — биовар microtus [11]. Эта классификация, построенная на основе эпидемиологического критерия — гипотезы о трех последних пандемиях (хотя человек не имел ни прямого, ни косвенного отношения к происхождению возбудителя), считается устаревшей, однако пока молекулярные признаки соотносят именно с ней.
В России для анализа генетических данных используют классификацию, в основе которой лежит подразделение на «подвиды»: основной (сюда входят биовары antiqua, mediaevalis, orientalis) и дополнительные (кавказский, улегейский, гиссарский, алтайский и др.), циркулирующие в популяциях полевок и пищух в определенных географических регионах. Эта классификация столь же несовершенна, как и предыдущая. По генетическим и классическим признакам она редуцирована (на самом деле внутривидовое разнообразие гораздо богаче); асимметрична (основной подвид распространен почти по всему миру, а дополнительные — точечно); не вполне логична (основной подвид объединяет две географически разобщенные формы с разными отношением к ферментации глицерина); терминологически неадекватна («полевковый» подвид представлен как исходный для филума Y. pestis, а именуют его дополнительным, несущественным; и почему-то в категории «полевковых» (группа Pestoides) оказались подвиды altaica и ulegeica, характерные для двух соседствующих на Алтае и на западе Монголии популяций монгольской пищухи (Ochotona pricei). Однако в силу инертности систематиков-микробиологов классификация не сдана в архив и остается ориентиром в филогенетических построениях российских молекулярных генетиков.
Использование западными и российскими исследователями разных классификаций для анализа и «привязки» молекулярных признаков и реконструкции по ним филогенезов создает определенный методологический хаос: каждый думает, конструирует, убеждает и утверждает свои идеи сам по себе, едва лишь вдаваясь в полемику с оппонентами. Но естественная система — одна, и при разных методах исследований желателен единый и надежный ориентир. Таким видится гостальный (host — хозяин) принцип классификации и придание подвиду Y. pestis tarbagani статуса исходного, первичного [3].

Схема филогенеза возбудителя чумы Y. pestis (видообразование, внутривидовая дифференциация), построенная на основе экологических признаков [13]. А, Б, В — область экологической достоверности генетических признаков, которые можно привлекать для интерпретации видообразования [3, 15]. Там происходили молекулярные преобразования: начальное «заякоривание» и размножение псевдотуберкулезного микроба в новой среде — лимфомиелоидном комплексе сурка тарбагана за счет преадаптаций и определенного сходства свойств мертвой внешней органики и «холодной» крови спящих сурков; транзит признаков предка (плезиоморфий) в новую производную форму; формирование новых, специфических для чумного микроба структур и функций (апоморфий); утеря некоторыми сохранившимися генами своих функций (инактивация); деградация ненужных в новых условиях структур и функций (делеции); встраивание (инсерции) и дубликация мобильных генов в микробных клетках. Все имеющиеся генетические данные об этих преобразованиях требуют глубокого адаптационного осмысления
Интерпретация молекулярно-генетических данных во многом зависит от решения проблемы родства и сходства, т. е. используемых для филогенетических реконструкций гомологичных признаков [15]. Их надо уметь надежно отличать от гомоплазий — параллелизмов, которые в биологическом мире распространены чрезвычайно широко. Пока не вполне ясно, всякая ли мутация, обнаруженная у двух любых организмов, унаследована от их общего предка. Надо полагать, далеко не всякая. Например, пока нельзя утверждать, что способность «полевковых» подвидов Rha+ и Mlb+ ферментировать рамнозу и мелибиозу унаследована от предкового псевдотуберкулезного микроба. Говоря иначе, «полевковые» ли подвиды — прямые наследники псевдотуберкулезного предка, т. е. самая древняя форма микроба чумы? Скорее всего, это наиболее молодая полифилетическая группа подвидов, не имеющих между собой прямых родственных связей. При этом пока неясно функциональное значение используемых диагностических признаков. Прояснить такие затруднительные ситуации помогут факты-признаки, представляемые другими науками. В вопросах с «полевковыми» подвидами и очагами чумы много подсказок дает знание экологии и биогеографии представителей подсемейства Microtinae.
Сегодня описано множество генетических признаков микроба Y. pestis, среди которых, безусловно, найдутся и соответствующие экологическому сценарию. Нужно только их выявить, обосновать и «вплести» в экологическую «канву». Появление единой версии, в которой будут сочетаться и однозначно толковаться все факты-признаки, относящиеся к разным структурным уровням организации живой материи, позволит понять происхождение воистину апокалиптического для человечества явления, именуемого чумой.
Литература
1. Супотницкий М. В., Супотницкая Н. С. Очерки истории чумы. Кн. 1–2. М., 2006.
2. Сунцов В. В. и др. Структура и генезис эпизоотических систем «грызун — блоха — микроб Yersinia pestis» в ценозах Вьетнама, включая территории экоцида // Окружающая среда и здоровье человека в загрязненных диоксинами регионах Вьетнама / Ред. В. С. Румак. М., 2011. С. 202–258.
3. Сунцов В. В., Сунцова Н. И. Чума. Происхождение и эволюция эпизоотической системы (экологические, географические и социальные аспекты). М., 2006.
4. Wu Lien The et al. Plague: a manual for medical and public health workers. Shanghai, 1936.
5. Bercovier H. et al. Intra- and interspecies relatedness of Yersinia pestis by DNA hibridization and its relationship to Yersinia pseudotuberculosis // Curr. Microbiol. 1980. V. 4. № 4. P. 225–229.
6. Achtman M. et al. Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis // Proc Nat. Acad. Sci. (USA). 1999. V. 96. № 24. P. 14043–14048.
7. Skurnik M. et al. Characterization of the O-antigen gene cluster of Yersinia pseudotuberculosis and the cryptic O-antigen gene cluster of Yersinia pestis shows that the plague bacillus is most closely related to and has evolved from Y. pseudotuberculosis serotype O:1b // Molec. Microbiol. 2000. V. 37. № 2. P. 316–330.
8. Morelli G. et al. Yersinia pestis genome sequencing identifies patterns of global phylogenetic diversity // Nat. Genet. 2010. V. 42 (12). P. 1140–1143.
9. Вариабельность возбудителя чумы и проблемы его диагностики / Ред. Ю. М. Ломов. Ростов-на-Дону, 2009.
10. Owen L. A. et al. Relict permafrost structures in the Gobi of Mongolia: age and significance // J. Quaternary Sci. 1998. V. 13. № 6. P. 539–547.
11. Li Y. et al. Genotyping and phylogenetic analysis of Yersinia pestis by MLVA: insights into the worldwide expansion of Central Asia plague foci // PLoS One. 2009. V. 4 (6): e6000.
12. Бобров А. Г., Филиппов А. А. Распространенность IS285 и IS100 в геномах Yersinia pestis и Yersinia pseudotuberculosis // Молекул. генет. 1997. Вып. 2. С. 36–40.
13. Сунцов В. В. Происхождение возбудителя чумы — микроба Yersinia pestis: структура видообразовательного процесса // Изв. РАН. Сер. биол. 2012. № 1. С. 5–13.
14. Devignat R. Varietes de l’espece Pasteurella pestis. Nouvelle hypothese // Bull. WHO. 1951. V. 4. № 2. P. 242–263.
15. Павлинов И. Я. «Новая филогенетика»: источники и составные части // Эволюционные факторы формирования разнообразия животного мира. Отв. ред. Э. И. Воробьева, Б. Р. Стриганова. М., 2005. С. 15–29.