Тар блок что это
Анальгетическая эффективность поперечного плоскостного блока живота после кесарева сечения: рандомизированное контролируемое исследование
John G. McDonnell, MB, FCARCSI*, Gerard Curley, MB*,
John Carney, MB*, Aoife Benton, MB, Joseph Costello,
MB, FCARCSI*, Chrisen H. Maharaj, MB, BSc,
FCARCSI, DPM*, and John G. Laffey, MD, MA, BSc, FCARCSI*
*Department of Anaesthesia, Clinical Sciences Institute,
Centre for Pain Research, National University of Ireland;
and Department of Anaesthesia and Intensive Care Medicine,
University Hospital Galway, Galway, Ireland.
МЕТОДЫ: Пятьдесят женщин, перенесших плановое родоразрешение путем кесарева сечения, были распределены, чтобы перенести ТАР блок ропивакаином (n = 25) против плацебо (n = 25), в дополнение к стандартной послеоперационной аналгезии, включающей управляемую пациентом IV аналгезию морфином и регулярный диклофенак и парацетамол. Все пациентки получали стандартную спинальную анестезию и, в конце операции, выполнялся двусторонний ТАР блок с использованием 1.5 мг/кг ропивакаина (в максимальной дозе 150 мг) или солевой раствор с каждой стороны. Каждая пациентка оценивалась послеоперационно исследователем, не знающим о групповом распределении: в отделении постнаркозного лечения через 2, 4, 6, 12, 24, 36, и 48 часов послеоперационно.
Родоразрешение путем кесарева сечения – основная операция в акушерстве, после которой может ожидаться реальный послеоперационный дискомфорт или боль.[1] Эффективная послеоперационная аналгезия имеет ключевое значение для облегчения ранней активизации, ухода за новорожденным (включая кормление грудью, связь матери с ребенком) и профилактики осложнений послеоперационного периода.[1] Целью аналгетического режима является обеспечение безопасной, эффективной аналгезии, с минимальными побочными эффектами для матери и ребенка.
Значительный компонент боли, испытываемой пациентами после абдоминальных операций, порождается разрезом передней брюшной стенки. Боковая брюшная стенка с обеих сторон состоит из трех слоев мышц: наружной косой, внутренней косой и поперечной мышцы живота и их фасциальных оболочек. Передняя брюшная стенка также включает прямую мышцу живота и ее фасциальную оболочку. Нервы, иннервирующие переднюю брюшную стенку проходят через нейро-фасциальную плоскость между внутренней косой мышцей и поперечной мышцей живота.[2] Основываясь на анатомических исследованиях, наша группа идентифицировала поясничный треугольник Petit как точку доступа к этой нейро-фасциальной плоскости ( рис. 1 ).
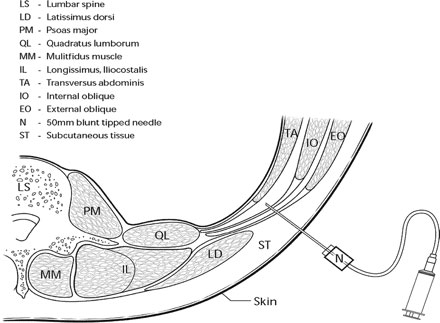 |
| Рисунок 1. Схема линии поперечного брюшной стенки на уровне поясничного треугольника Petit (ТОР). Дно треугольника представлено вглубь от поверхности фасциальной частью наружной косой, внутренней косой и поперечной мышцы живота соответственно и брюшиной. Игла введена через треугольник, используя методику потери сопротивления. Игла изображена в поперечной плоскости живота, а фасциальные слои разделились в результате иньекции местного анестетика. |
Рандомизированно распределенные пациентки получали ТАР блок ( n = 25) 1.5 мг/кг 0.75 % ропивакаина (максимальная доза 150 мг) с обеих сторон или ТАР блок 0.9 % хлоридом натрия (контроль, n = 25). Последовательность распределения генерировалась таблицей случайных чисел, групповое распределение было скрыто запечатанным непрозрачным снимающимся защитным покрытием, которое не снималось до получения согласия пациентки. Пациентки, анестезиологи и персонал, обеспечивающий послеоперационную терапию, не знали о групповом распределении. Все пациентки получали стандартную спинальную анестезию 12 мг 0.5 % гипербарического бупивакаина с 25 µ g фентанила. Пациентки также получали 1 мг/кг диклофенака ректально до максимальной дозы 100 мг и 1 г парацетамола ректально в конце операции. Антиэметики профилактически не применялись.
Таблица 1. Основные характеристики пациентов.
| Группа | Контроль (n=25) | ТАР блок (n=25) |
| Возраст (лет) | 34±5 | 35±4 |
| Вес (кг) | 78±17 | 71±10 |
| Рост (м) | 1.65±0.06 | 1.64±0.06 |
| Индекс массы тела (кг/м 2 ) | 28±6 | 26±3 |
| Предыдущие абдоминальные операции [n( % )] | 15(60) | 16(64) |
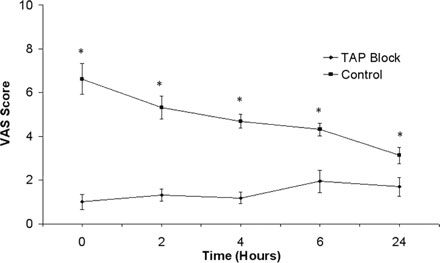
Послеоперационная боль по ВАШ, измеренная в покое и при перемещении, была уменьшена после ТАР блока в некоторых, но не всех, оцениваемых временных точках ( Рисунок 4 ). Категорическая оценка боли была ниже у больных, получавших ТАР блок во всех послеоперационных временных точках (данные не показаны).
Блокада поперечного пространства живота (TAP-блок)
Регионарная анестезия развивается очень быстро. Полученные за последние годы данные об эффективности блокады поперечного пространства живота (БППЖ, Transversus Abdominis Plane block — TAP) обусловили появление значительного интереса к ней. Этот тип регионарной анестезии вызывает сенсорную блокаду нижнего отдела брюшной стенки за счет введения местного анестетика в пространство, расположенное над поперечной мышцей живота (m. transversus abdominis).
Блокады различных областей брюшной стенки и реберно-подвздошная блокада используются при операциях на животе уже на протяжении нескольких десятилетий. В 80-х годах прошлого столетия широко применялась методика многократных инъекций местного анестетика в брюшную стенку. В дальнейшем техника блокады передней брюшной стенки была улучшена путем применения для ориентира поясничного треугольника ПТИ (Petit). Эффективность методики с использованием анатомических ориентиров, а позже и блокады с ультразвуковой визуализацией была оценена в нескольких клинических исследованиях.
Анатомия
Иннервация переднебоковых областей брюшной стенки осуществляется передними ветвями спинномозговых нервов T7—L1. К ним относятся межреберные (T7—T11) и подреберный (T12) нервы, илиогипогастральный и илиоингвинальный нервы (L1). В свою очередь, все они дают начало поверхностным боковым и передним кожным ветвям. Межреберные нервы с T7 до T11 выходят из межреберных промежутков и располагаются в сосудисто-невральном пространстве между внутренней косой и поперечной мышцами живота. Подреберный (T12), илиоингвинальный и илиогипогастральный нервы (L1) также проходят между поперечной и косой мышцами живота, иннервируя каждую из них.
Продолжаясь от поперечной фасции кпереди, ветви с T7 до T12 проходят через прямую мышцу живота и заканчиваются как передние кожные нервы. Грудные нервы, с T7 до T12, обеспечивают моторную иннервацию пирамидальной и прямой мышцы живота. Их окончаниями являются кожные латеральные нервы живота. Нервы T7—T11 обеспечивают сенсорную иннервацию кожи, реберной части диафрагмы и прилежащей париетальной плевры, брюшины. T7 отвечает за сенсорную иннервацию в эпигастрии, T10 — пупка, а L1 — паха.
Клинические Показания
БППЖ может использоваться при любых операциях на нижнем этаже брюшной полости. Это и хирургия кишечника, и кесарево сечение, и удаление аппендицита, и грыжесечение и оперативная гинекология. Одной инъекцией можно добиться сенсорной блокады весьма значительной зоны брюшной стенки. Она будет особенно полезна при противопоказаниях к эпидуральной анестезии или неудаче при ее выполнении.
Блокаду можно выполнить с одной стороны (например, при аппендэктомии) или с двух сторон, когда разрез проходит через срединную линию (например, разрез по Пфанненштилю). Для анестезии может применяться методика однократной инъекции, в то время как для продленной послеоперационной анальгезии можно использовать и катетерную технику. БППЖ может использоваться и как анальгезия спасения у пациентов, прооперированных на животе, у которых регионарная анестезия во время операции не применялась.
Техника выполнения
При выполнении БППЖ местный анестетик вводят в пространство между внутренней косой и поперечной мышцами. Существует две основные методики проведения блокады. Одна из них, «вслепую», основана на использовании поверхностных анатомических ориентиров, а другая — прямой ультразвуковой визуализации. Техника каждой описана ниже.
При использовании БППЖ как части анестезиологического пособия для разреза кожи и начала самой операции может потребоваться введение опиоидов, поскольку для развития эффекта при БППЖ необходимо выждать порядка 30 минут. Внутривенный опиат требуется для разреза кожи и раннего действующего периода, поскольку блок становится установленным. При кесаревом сечении БППЖ выполняется в конце операции, и соответственно в раннем послеоперационном периоде, пока не сформировалась адекватная сенсорная блокада, для обезболивания также может потребоваться внутривенное введение опиоидов.
Главной составляющей успеха при выполнении БППЖ является объем вводимого анестетика. У среднестатистического взрослого для односторонней блокады необходимо использовать 30 мл местного анестетика, а для двусторонней — 25–30 мл с каждой стороны. И лидокаин, и бупивакаин, и ропивакаин с успехом применяются для выполнения данной блокады. Применение адекватного объема препарата более важно, чем использование его высоких концентраций. При выполнении блокады необходимо строго придерживаться максимально допустимых доз. Примеры дозировок приведены в таблице 1.
Анатомические ориентиры
Ориентир для пальпации — треугольник ПТИ, располагающийся над подвздошной костью по средней подмышечной линии. Нижней границей треугольника является гребень подвздошной кости. Переднюю границу треугольника образует боковой край наружной косой мышцы. Задняя граница треугольника сформирована боковым краем широкой мышцы спины. У пациентов в сознании глубокая пальпация данного треугольника болезненна.
Точка вкола находится над подвздошным гребнем кзади от средней подмышечной линии в пределах треугольника ПТИ. Тупоконечную 50-мм иглу калибра 24G вводят перпендикулярно к коже. При прохождении ее через фасцию внутренней косой мышцы ощущается характерный щелчок. В этот момент кончик иглы находится между фасциальными слоями наружной и внутренней косых мышц. Появление второго «щелчка» при дальнейшем продвижении иглы указывает на то, что ее кончик попал в фасциальное пространство над поперечной мышцей живота. После аспирационной пробы, вводится 25–30 мл местного анестетика.
Треугольник ПТИ нередко трудно пропальпировать, особенно у тучных пациентов. При сложностях в его определении целесообразно вводить иглу на 2,5 см кзади от самой высокой точки гребня подвздошной кости. Если попросить пациента в положении на спине поднять вверх голову и руки, мышцы живота сократятся, что облегчит пальпацию треугольника.
Дата добавления: 2018-11-24 ; просмотров: 2890 ; Мы поможем в написании вашей работы!
Эффективность анальгезии поперечного абдоминального плоскостного блока после абдоминальной хирургии: проспективное рандомизированное контролируемое испытание
John G. McDonnell, MB, FCARCSI*, Brian O’Donnell, MB,
FCARCSI, Gerard Curley, MB*, Anne Heffernan, MB,
FCARCSI, Camillus Power, MD, FCARCSI,
and John G. Laffey, MD, MA, FCARCSI*
From the *Department of Anaesthesia and Intensive Care Medicine,
University College Hospital, Galway;
Department of Anaesthesia and Intensive Care Medicine,
Adelaide and Meath Hospitals, Tallaght, Dublin;
and Department of Anaesthesia, Clinical Sciences Institute,
National University of Ireland, Galway, Ireland.
Реферат
Существенная боль, испытываемая пациентами после абдоминальных операций, обусловлена разрезом передней брюшной стенки (1). Брюшная стенка состоит из трех слоев мышц – внешне косой, внутренней косой, поперечной мышцы живота и их фасциальных оболочек. Средняя область брюшной стенки также включает в себя прямые мышцы живота с фасциальными оболочками. Эта мышечная стенка иннервируется афферентными нервами, проходящими поперечно через нейро-фасциальную плоскость живота (2).
Перспективный подход к послеоперационной анальгезии после лапаротомии предполагает блокаду сенсорных нервов подходящих к передней брюшной стенке (3, 4). Однако, клиническое значение существующих подходов к блокаде афферентных нервов, таких как локальные абдоминальные блоки, ограничено, а степень достигнутого блока может быть непредсказуемой. Главная причина недостаточной эффективности этих блоков – отсутствие четких анатомических ориентиров, приводящее к невозможности точного позиционирования иглы и отсутствию ясных признаков того, что местный анестетик средство вводится в правильной анатомической плоскости.
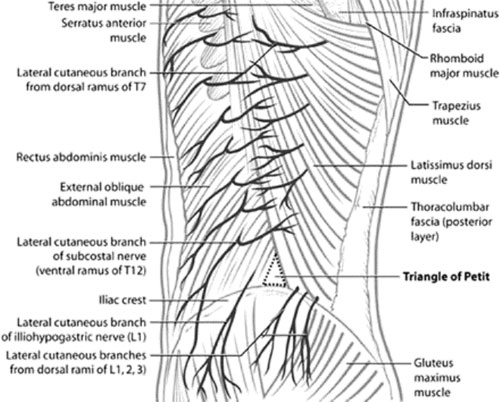 |
| Иллюстрация 1. Схематическая анатомия брюшной стенки, включая поясничный треугольник Petit (TOP). Треугольник ограничивается сзади широчайшей мышцей спины, спереди наружной косой мышцей, с подвздошным гребнем, формирующим основание треугольника. |

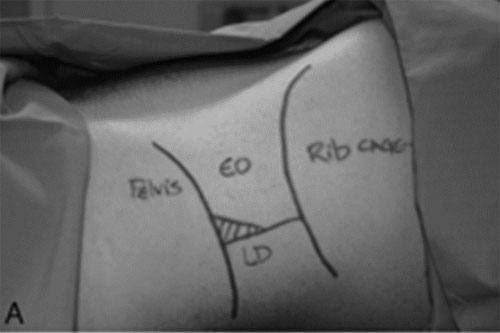 |
 |
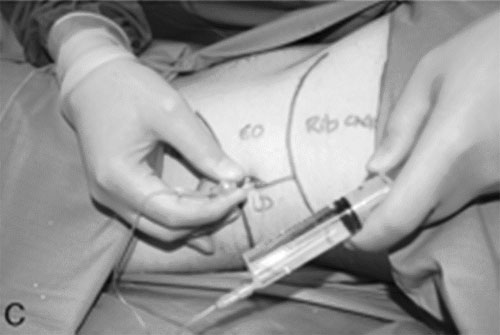 |
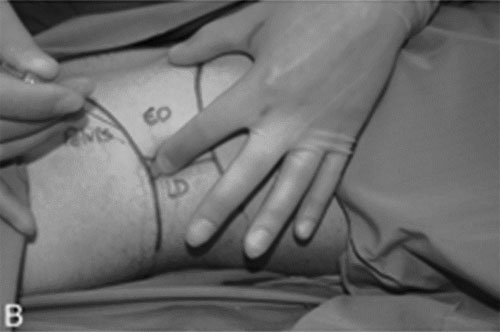
| Иллюстрация 2. A : Наружная анатомия TOP. B : Место введения иглы в TOP. C : Иньекция местного анестетика через иглу, введенную в нейрофасциальную плоскость поперечной мышцы живота ( transversus abdominis ) через TOP. TOP = поясничный треугольник Petit ; LD = широчайшая мышца спины (latissimus dorsi ); EO = наружная косая мышца (externa obliqua) |
После завершения операции и выхода пациентовиз анестезии, они переводились в отделение лечения после анестезии (PACU). В обеих группах использовался стандартный послеоперационный анальгетический режим, состоящий из парацетамола 1 г перорально каждые 6 часов и диклофенака по 100 мг ректально каждые 18 часов в комбинации с контролируемой пациентом анальгезией морфином (болюс 1 мг, 6-минутная блокировка, максимальная доза 40 мг каждые 4 ч). Наличие боли и ее интенсивность, факты тошноты, выраженность и наличие седативного эффекта систематически оценивались и регистрировались исследователем, не знающем о распределении групп.
Эти исследования были выполнены в PACU через 2, 4, 6 и 24 часа после операции. Всех пациентов попросили дать оценку их боли в покое и при перемещении, а также просили сообщить о наличии и степени тошноты во время этих временных этапов. Интенсивность боли оценивалась с использованием визуальной аналоговой шкалы (visual analog scale ) (0 = отсутствие боли, 10 = максимально вообразимая) и категорической системы оценки боли (categorical pain scoring system) (нет = 0; умеренная = 1; средняя = 2; тяжелая = 3). Тошнота была измерена с использованием категорической системы оценки (нет = 0; умеренная = 1; средняя = 2; тяжелая = 3). Оценка седативного эффекта проводилась независимым экспертом с использованием шкалы седации (активный и тревожный = 0; спокойно бодрствующий = 1; дремлющий, но легко пробуждаемый = 2; глубоко спяший = 3). Антиэметики в экстренном порядке предлагались любому пациенту, который жаловался на тошноту или рвоту.
Таблица 2. Послеоперационная оценка боли и требование анальгезии