Тофацитиниб или барицитиниб что лучше
Эксперты сравнили безопасность ингибиторов янус-киназ в терапии ревматоидного артрита
Исследователи из Университета Гриффита в Австралии оценили безопасность новой группы лекарственных средств – ингибиторов янус-киназы (JAK). Сравнивались параметры безопасности четырех препаратов: тофацитиниба, барицитиниба, упадацитиниба, filgotinib.
Ингибиторы JAK применяются для лечения ревматоидного артрита (РА). Предполагается, что они обладают разной селективностью, а это может влиять на профиль безопасности у пациентов. Обзор опубликован в журнале International Journal of Rheumatic Diseases.
Вас также заинтересует
Эксперты оценили доступные параметры безопасности четырех ингибиторов JAK: тофацитиниба, барицитиниба, упадацитиниба, filgotinib. Данные о долгосрочной безопасности ограничены.
Авторы исследования указали, что упадацитиниб и filgotinib могут иметь лучшие профили безопасности в отношении риска развития опоясывающего герпеса, венозной тромбоэмболии и перфорации желудочно-кишечного тракта.
Не проводились исследования безопасности и эффективности замены препаратов внутри группы, поэтому не следует без особой необходимости менять препараты в рамках проводимой терапии.
Кардиоваскулярные события при приеме ингибиторов JAK
Систематический обзор и метаанализ показали: краткосрочное использование ингибиторов JAK не приводило к значимому росту числа сердечно-сосудистых событий по сравнению с плацебо. Венозная тромбоэмболия как побочный эффект встречается относительно редко.
Злокачественные новообразования
Обнаружилось небольшое повышение частоты злокачественных новообразований у пациентов с РА, получавших ингибиторы JAK. Однако разница не была статистически значимой по сравнению с группой контроля.
Частота злокачественных новообразований при монотерапии тофацитинибом составляла 0,9 случая на 100 пациенто-лет, при использовании барицитиниба — 0,7, упадацитиниба 15 мг — 0,8.
Пока недостаточно клинических данных для оценки частоты злокачественных новообразований после воздействия filgotinib.
Перфорация желудочно-кишечного тракта (ЖКТ)
В ходе проводимых исследований у пациентов с РА сообщалось о случаях перфорации ЖКТ, однако не было однозначного подтверждения роли JAK. Имеющиеся данные говорят о наиболее низкой встречаемости таких событий при использовании барицитиниба и filgotinib.
Авторы обзора указывают на необходимость проведения регулярных обследований пациентов с повышенными рисками или в случае появления абдоминальных симптомов перфорации при терапии ингибиторами JAK.
Эффективность и безопасность тофацитиниба у пациентов с COVID-19: многоцентровое нерандомизированное контролируемое исследование
Изучить эффективность и безопасность тофацитиниба у госпитализированных пациентов с COVID-19 ассоциированной пневмонией.
Материалы и методы
В многоцентровое нерандомизированное контролируемое исследование включали пациентов с COVID-19 ассоциированной пневмонией, сопровождавшейся снижением сатурации крови кислородом в покое (SpO 2 ), повышенным уровнем С-реактивного белка (≥50 мг/л) и/или персистирующей лихорадкой. Пациентам основной группы назначали тофацитиниб в дополнение к стандартной терапии, в то время как больные контрольной группы получали только стандартную терапию. Суммарную частоту перевода на инвазивную вентиляцию легких (ИВЛ) и смерти во время госпитализации (первичная конечная точка) анализировали отдельно в двух когортах пациентов, выделенных в зависимости от исходной SpO 2 (≤93% и >93%). Отношения рисков (ОР) и доверительные интервалы (95% ДИ) рассчитывали с использованием регрессии Кокса и поправкой на взвешенный propensity matching score.
В исследование были включены 384 пациента с COVID-19 (212 мужчин, медиана возраста 60 лет); 131 из них получали тофацитиниб, 253 – только стандартную терапию. Среди больных со сниженной SpO 2 частота комбинированной первичной конечной точки в группе тофацитиниба и контрольной группе составила 12,5% (9/72) и 14,1% (26/185), соответственно (ОР 0,92, 95% ДИ 0,33-2,56), а среди больных с нормальной SpO 2 – 1,7% (1/59) и 4,4% (3/68), соответственно (ОР 0,83, 95% ДИ 0,07-9,44).
Патогенез тяжелого течения COVID-19 предполагает развитие чрезмерного воспалительного ответа, вызванного SARS-CoV-2 и характеризующегося значительным повышением содержания различных цитокинов и воспалительных биомаркеров, в частности С-реактивного белка (СРБ). Эти изменения сходны с “цитокиновым штормом», который наблюдается при синдроме активации макрофагов или после CAR-T-клеточной терапии [1,2]. Факторы риска тяжелого течения COVID-19 включают в себя пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет и коронарную болезнь сердца [3,4]. Эф фективные противовирусные препараты, которые могли бы предотвратить развитие избыточного иммунного ответа при COVID-19, по прежнему отсутствуют. В открытом рандомизированном клиническом исследовании у 168 пациентов с COVID-19 легкого или средне-тяжелого течения применение фавипиравира привело к более быстрому улучшению состояния пациентов по сравнению со стандартной терапией (умифеновир + интраназальный интерферон a2b или гидроксихлорохин), хотя медиана времени до элиминации вируса достоверно не отличалась между группами, а эффективность препарата в профилактике неблагоприятных исходов COVID-19 остается недоказанной [5].
На практике для лечения COVID-19 средней тяжести и тяжелого течения широко применяют глюкокортикостероиды и различные антицитокиновые препараты (в частности, ингибиторы интерлейкина-6), которые изучались в многочисленных наблюдательных и ран домизированных клинических исследованиях [6]. В исследовании RECOVERY применение глюкокортикостероида дексаметазона, обладающего широким спектром противовоспалительной активности, привело к снижению 28-дневной летальности у госпитализированных пациентов с COVID-19, нуждавшихся в респираторной поддержке, причем наиболее выраженный эффект был достигнут у больных, находившихся на ИВЛ [7]. Благоприятное влияние тоцилизумаба на летальность больных с COVID-19 было показано в многочисленных сериях наблюдений и нерандомизированных клинических исследованиях [8], но не подтверждено в нескольких рандомизированных клинических исследованиях [9,10]. В ретроспективном когортном исследовании у 328 пациентов с тяжелой COVID-19 пневмонией, госпитализированных в российские отделения реанимации и интенсивной терапии (ОРИТ), как более раннее, так и позднее введение тоцилизумаба, т.е. до или после интубации, не сопровождалось снижением летальности от всех причин [11]. В то же время в крупном рандомизированном исследовании RECOVERY у неинтубированных больных с гипоксией и признаками системного воспаления введение тоцилизумаба в дополнение к стандартной терапии привело к достоверному снижению риска перевода на ИВЛ или смерти на 16% (p
Материал и методы
Дизайн исследования. Многоцентровое нерандомизированное контролируемое исследование TOFA-COV-2 проводилось в трех клиниках Сеченовского университета, перепрофилированных в инфекционные госпитали. В исследование включали взрослых (≥18 лет) пациентов со среднетяжелым течением COVID-19, госпитализированных в университетские клиники с 17 апреля по 1 августа 2020 г. Диагноз COVID-19 был подтвержден при помощи полимеразной цепной реакции (ПЦР) и/или компьютерной томографии (КТ) органов грудной клетки. У пациентов с сомнительным или отрицательным результатом ПЦР назофарингеального мазка наличие пневмонии, вызванной вирусом SARS-CoV-2, устанавливали при наличии симптомов острой респираторной инфекции, типичных КТ-признаков (4 или 5 по шкале CO-RADS) и исключении других явных причин заболевания [17]. Объем поражения легочной паренхимы (0-24%, 25-49%, 50-74%, ≥75%) оценивали в пяти областях в соответствии с анатомическим строением легких: левая верхняя доля, левая нижняя доля, правая верхняя доля, правая средняя доля и правая нижняя доля.
Исследование было одобрено Этическим комитетом Сеченовского университета. Все пациенты подписали добровольное информированное согласие на использование экспериментальной терапии в соответствии с Временными методическими рекомендациями Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Протокол исследования зарегистрирован на сайте clinicaltrials.gov (NCT04750317).
Медикаментозная терапия. Тофацитиниб применяли в течение 5 дней в дозе 10 мг два раза в сутки в первый день, а затем по 5 мг два раза в сутки. У пациентов с рСКФ 2 дозу снижали до 5 мг один раз в сутки. Доза препарата и длительность терапии были выбраны на основе доз, рекомендуемых для лечения ревматоидного артрита. Мы предполагали, что большая интенсивность иммуносупрессии, в частности прием тофацитиниба в более высокой дозе и в течение более продолжительного времени, не является необходимой и может быть опасной у пациентов с активной вирусной инфекцией. Кроме того, у госпитализированных пациентов с COVID-19 возможно увеличение риска развития некоторых побочных эффектов тофацитиниба, таких как вторичные инфекции, вызванные бактериальными или вирусными агентами, лимфопения и венозные тромбоэмболические осложнения [18].
Все пациенты во время госпитализации получали стандартную терапию в соответствии с Временными методическими рекомендациями Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Необходимое лечение определялось лечащим врачом и могло включать в себя введение увлажненного кислорода (целевой уровень сатурации крови кислородом ≥93% в покое), применение гидроксихлорохина (400 мг два раза в сутки в первый день, затем по 200 мг два раза в сутки), азитромицина, лопинавира/ ритонавира (400/100 мг два раза в сутки) и низкомолекулярного гепарина в соответствии с массой тела и фильтрационной способностью почек. Внутривенное введение дексаметазона допускалось в дозе не более 16 мг/сут.
Показатели эффективности и безопасности. Первичной комбинированной конечной точкой была частота смерти от всех причин во время госпитализации или перевода на ИВЛ, вторичными – два компонента первичной конечной точки по отдельности. Риск смерти у пациентов с COVID-19 зависит от необходимости в респираторной поддержке и от ее типа (введение увлажненного кислорода, неинвазивная вентиляция легких или ИВЛ), который отражает тяжесть острого респираторного дистресс синдрома (ОРДС). По данным нашего предыдущего исследования, в российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%. У пациентов, находившихся на оксигенотерапии она равнялась 10,1%, а при переводе на неинвазивную вентиляцию легких и ИВЛ увеличивалась до 36,8% и 76,5%, соответственно [19]. В связи с этим, все больные, принимавшие участие в исследование TOFA-COV-2, были разделены на две когорты в зависимости от SpO2 и необходимости в респираторной поддержке на момент включения в исследование: ≤93% (когорта 1) и >93% (когорта 2). Исходы оценивали раздельно в двух когортах. Первичные и вторичные конечные точки анализировали проспективно в группе тофацитиниба и ретроспективно на основании медицинской документации в контрольной группе.
Статистический анализ. Нормальность распределения данных оценивали с помощью теста Шапиро-Уилка. Демографические и исходные клинические показатели представлены в виде медианы и межквартильного интервала (IQR) для непрерывных переменных и в виде процентов для категориальных переменных. Сравнение непрерывных переменных в группе тофацитиниба и контрольной группе проводилось с использованием U-критерия Манна-Уитни для двух групп и критерия Краскелла-Уоллеса для трех групп. Категориальные переменные между группами сравнивали при помощи точного теста Фишера или критерия χ 2 Пирсона.
Все участники находились под наблюдением с момента включения в исследование до выписки или смерти. Выживаемость и время до интубации или смерти сравнивали между двумя группами с помощью невзвешенных кривых Каплана-Мейера и однофакторной и многофакторной модели регрессии Кокса c фиксированными ковариатами. Рассчитывали отношения рисков (ОР) и 95% доверительные интервалы (ДИ). В базовую модель была внесена поправка на обратно взвешенные коэффициенты предрасположенности (propensity matching). Валидность регрессионной модели проверяли путем оценки пропорциональных рисков с использованием метода остатков Шонфельда.
Различия считали статистически значимыми при p менее 0,05. Статистическая обработка данных осуществлялась с использованием программного обеспечения IBM SPSS Statistics, version 22 (IBM Corporation, USA).
Результаты
Общая характеристика пациентов. В исследование были включены 384 пациента с COVID-19 средней тяжести, в том числе 212 (55,2%) мужчин. Медиана возраста составила 60 лет (IQR 48-70). Диагноз COVID-19 был подтвержден исследованием мазка из носоглотки методом ПЦР у 180 (46,9%) пациентов, однако у всех пациентов имелись типичные КТ-признаки COVID-19 ассоциированной пневмонии, а балл по шкале CO-RADS составлял 4 или 5. CO-RADS представляет собой стандартизированную систему классификации пациентов с подозрением на COVID-19 и позволяет оценить вероятность наличия заболевания на основании КТ органов грудной клетки – от очень низкой (CO-RADS 1) до очень высокой (CO-RADS 5) [17]. Медиана продолжительности пребывания в больнице до смерти или выписки составила 16 дней (IQR 14-20). 131 (34,1%) пациент получали тофацитиниб в дополнение к стандартному лечению, а 253 (65,9%) – только стандартную терапию. Исходные клинические и демографические показатели пациентов с низкой и нормальной SpO2, получавших тофацитиниб или стандартную терапию, представлены в табл. 1 и 2.
С помощью метода Каплана-Мейера мы не выявили различий кумулятивной частоты первичной или вторичных конечных точек между двумя группами (рис. 1). По данным регрессионного анализа Кокса, добавление тофацитиниба к стандартному лечению не привело к снижению риска развития первичной или вторичных исходов (табл. 3).
| Когорты/конечные точки | Нескорректированное ОР (95% ДИ) | p | Скорректированное ОР (95% ДИ) | p |
|---|---|---|---|---|
| Пациенты со сниженной SpO2 | ||||
| Смерть или перевод на ИВЛ | 0,91 (0,42–1,97) | 0,82 | 0,92 (0,33-2,56) | 0,87 |
| Перевод на ИВЛ | 0,67 (0,25–1,78) | 0,42 | 0,46 (0,11-1,99) | 0,30 |
| Смерть | 1,24 (0,54–2,84) | 0,62 | 1,25 (0,44-3,54) | 0,67 |
| Пациенты со нормальной SpO2 | ||||
| Смерть или перевод на ИВЛ | 0,76 (0,07–8,57) | 0,83 | 0,83 (0,07-9,44) | 0,88 |
| Смерть | — | — | — | — |
| Перевод на ИВЛ | 0,99 (0,09–11,08) | 0,99 | 1,10 (0,10 – 12,46) | 0,94 |
Пациенты с нормальной сатурацией кислорода. Исходно SpO2 в покое была нормальной (>93%) у 127 пациентов. 59 из них получали тофацитиниб в дополнение к стандартному лечению, а 68 – только стандартную терапию. Две группы были сопоставимы по различным параметрам, включая возраст, пол, индекс массы тела, сопутствующие заболевания, SpO2, количество лейкоцитов, нейтрофилов и лимфоцитов, сывороточный уровень креатинина. Как и в когорте 1, пациенты в группе тофацитиниба имели меньший объем зон “матового стекла» и более низкую медиану СРБ по сравнению с контрольной группой. Доля пациентов, получавших лечение глюкокортикостероидами и низкомолекулярными гепаринами, в группе тофацитиниба была значительно выше, чем в контрольной группе.
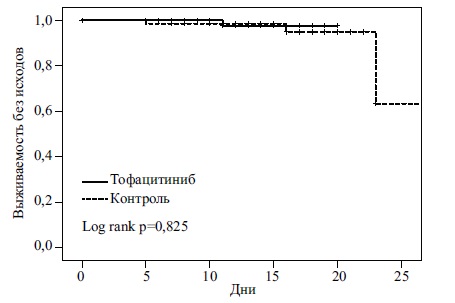
Первичная комбинированная конечная точка (смерть или перевод на ИВЛ) была достигнута у 1 (1,7%) из 59 пациентов, получавших тофацитиниб со стандартной терапией, и у 3 (4,4%) из 68 пациентов, получавших только стандартное лечение (ОР 0,83; 95% ДИ 0,07-9,44). Ни одному пациенту в группе тофацитиниба не потребовалась ИВЛ, тогда как 3 (4,4%) пациента в контрольной группе были интубированы во время пребывания в больнице (p=0,25). В группе тофацитиниба во время госпитализации умер 1 (1,7%) пациент, а в контрольной группе – 3 (4,4%) больных (ОР 1,10; 95 ДИ 0,10–12,46).
По данным анализа Каплана-Мейера, комбинированная терапия не имела преимуществ перед стандартной терапией по эффективности (рис. 2). При регрессионном анализе Кокса добавление тофацитиниба к стандартному лечению также не привело к снижению риска комбинированной первичной или вторичных конечных точек по сравнению со стандартной терапией (табл. 3).
Пациенты, получавшие глюкокортикоиды. Во время госпитализации 118 пациентов, включенных в исследование TOFA-COV-2, получали дексаметазон внутривенно (табл. 4). Среди 70 пациентов со сниженной SpO2, которым вводили глюкокортикостероиды, первичная конечная точка (смерть или перевод на ИВЛ) была достигнута у 4 (12,9%) из 31 пациента в группе тофацитиниба и у 11 (28,2%) из 39 пациентов в контрольной группе. ИВЛ потребовалась 1 (3,2%) и 10 (25,6%) пациентам, соответственно, а 4 (12,9%) пациента, получавших тофацитиниб и глюкокортикостероиды, и 9 (23,1%) пациентов, получавших только глюкокортикостероиды, умерли. Все различия частоты конечных точек между двумя группами не достигли статистической значимости в однофакторной модели регрессии Кокса.
| Конечные точки | Глюкокортикостероиды и тофацитиниб | Глюкокортикостероиды без тофацитиниба | ОР (95% ДИ) | p |
|---|---|---|---|---|
| Пациенты со сниженной SpO2 | ||||
| Число больных | 31 | 39 | ||
| Смерть или перевод на ИВЛ | 4 (12,9) | 9 (23,1) | 0,722 (0,219-2,385) | 0,593 |
| Перевод на ИВЛ | 1 (3,2) | 10 (25,6) | 0,135 (0,017-1,065) | 0,057 |
| Смерть | 4 (12,9) | 11 (28,2) | 0,517 (0,162-1,651) | 0,266 |
| Пациенты со нормальной SpO2 | ||||
| Число больных | 33 | 15 | ||
| Смерть или перевод на ИВЛ | 1 (3,0) | 2 (13,3) | 0,791 (0,046-13,597) | 0,871 |
| Перевод на ИВЛ | 0 | 2 (13,3) | не применимо | 0,631 |
| Смерть | 1 (3,0) | 2 (13,3) | 0,791 (0,046-13,597) | 0,871 |
Среди 48 пациентов с нормальной SpO2, получавших глюкокортикостероиды, комбинированная первичная конечная точка была достигнута у 1 (3,0%) из 31 пациента группы тофацитиниба, и у 2 (13,3%) из 15 пациентов контрольной группы. Различия частоты первичной и вторичных конечных точек между двумя группами в этой когорте также не достигли статистической значимости в однофакторной модели регрессии Кокса.
| Нежелательные явления | n (%) |
|---|---|
| Повышение активности печеночных ферментов | 14 (10,7) |
| Бактериальная пневмония | 6 (4,6) |
| Инфекция мочевыводящих путей | 2 (1,5) |
| Бактериальный сепсис | 2 (1,5) |
| Бактериальный колит | 1 (0,8) |
| Анемия | 2 (1,5) |
| Лейкопения | 1 (0,8) |
| Тромбоз яремной вены | 1 (0,8) |
| Кожные высыпания | 1 (0,8) |
| Пародонтит | 1 (0,8) |
| Инфаркт миокарда с подъемом сегмента ST | 1 (0,8) |
| Острое повреждение почек, потребовавшее диализа | 1 (0,8) |
| Желудочно-кишечное кровотечение | 1 (0,8) |
Безопасность. Побочные эффекты были выявлены у 34 (26,0%) из 131 пациента, получавшего тофацитиниб (табл. 5). Лечение тофацитинибом было прекращено у 7 (5,3%) пациентов из-за быстрого нарастания гипоксии (n=2) или серьезных побочных эффектов (n=5), которые включали инфаркт миокарда с подъемом сегмента ST (n=1), бактериальный сепсис (n=2), тромбоз яремной вены (n=1) и бактериальный колит (n=1).
Обсуждение
Тем не менее, у больных со сниженной и нормальной SpO2 тофацитиниб по эффективности в профилактике неблагоприятных исходов COVID-19 имел недостоверные преимущества перед контролем. Среди пациентов, нуждавшихся в респираторной поддержке на момент включения в исследования, частота смерти или интубации составила 12,5% и 14,1% в группе тофацитиниба и контрольной группе, соответственно, а среди пациентов с нормальной SpO2 – 1,7% и 4,4%. Эти различия могли быть связаны с более частым применением глюкокортикостероидов в группе тофацитиниба. В исследовании RECOVERY дексаметазон снижал летальность только у госпитализированных пациентов с более тяжелым COVID-19 [7]. Однако благоприятное влияние терапии глюкокортикостероидами на течение COVID-19 нельзя исключить и у пациентов с выраженной воспалительной реакцией даже при отсутствии гипоксии.
Использование глюкокортикостероидов было запрещено протоколом исследования ACTT-2, хотя эти препараты можно было применять по стандартным показаниям, включая септический шок и ОРДС. В исследовании ACTT-2 дексаметазон использовался только у 6,0% пациентов в группе барицитиниба. Напротив, системные глюкокортикостероиды применяли у 82% пациентов, которые были включены в группу тоцилизумаба в исследовании RECOVERY. Добавление тоцилизумаба к глюкокортикостероидам привело к снижению риска смерти от любых причин на 21%, тогда как этого преимущества не наблюдалось у пациентов, не получавших глюкокортикостероиды [12]. Приве денные данные свидетельствуют о том, что у пациентов с COVID-19 тоцилизумаб и, возможно, другие иммуномосупрессивные препараты следует назначать в дополнение к терапии глюкокортикостероидами. В нашем исследовании 31,2% пациентов получали дексаметазон внутривенно. Следует отметить, что набор в исследование TOFA-COV-2 проводился в начале пандемии COVID-19 в России, когда эффективность глюкокортикостероидов еще вызывала сомнение. В выборке больных со сниженной SpO2, которым вводили дексаметазон, добавление тофацитиниба к стандартной терапии сопровождалось более чем двукратным снижением частоты комбинированной конечной точки (смерти или ИВЛ) по сравнению с контрольной группой (12,9% против 28,2%). Как частота интубации, так и общая летальность также были ниже в группе тофацитиниба. Однако различия между двумя группами не достигли статистической значимости, вероятно, из-за ограниченного числа пациентов. Частота первичной и вторичных конечных точек была низкой у пациентов с нормальной SpO2 и не различалась между двумя группами. Терапия тофацитинибом хорошо переносилась пациентами исследуемой когорты и была отменена только у 5,4% пациентов.
Наше исследование имеет несколько ограничений. Во-первых, оно было нерандомизированном, а набор пациентов в контрольную группу осуществлялся ретроспективно на основании медицинской документации. Это не позволяло исключить возможность системной ошибки, связанной с отбором пациентов (selection bias). Чтобы исключить эффект различных факторов, способных повлиять на результаты лечения, в многофакторную модель Кокса была внесена поправка на propensity matching score. Следует отметить, что в обеих выборках в группах тофацитиниба объем поражения легочной ткани был ниже, а частота применения глюкокортикостероидов, наоборот, оказалась выше, чем в контрольных группах. Во-вторых, статистическая сила нашего исследования была ограниченной, особенно среди пациентов с нормальной SpO2, учитывая низкую частоту событий. Тем не менее, мы провели первое достаточно крупное контролируемое исследование с целью изучения эффективности тофацитиниба в профилактике неблагоприятных исходов у госпитализированных пациентов с COVID-19.
Заключение
Применение тофацитиниба в дополнение к стандартной терапии не привело к снижению риска смерти или перевода на ИВЛ у пациентов с COVID-19 средне-тяжелого течения как с пониженной, так и нормальной SpO2. У пациентов группы тофацитиниба, особенно получавших глюкокортикостероиды, частота комбинированной первичной конечной точки (смерть или интубация) и вторичных конечных точек была ниже, чем в контрольной группе, однако все различия между группами сравнения не достигли статистической значимости.

