Тромбофилия лейдена что это
Тромбофилия лейдена что это
Маркер связан с устойчивостью к действию активированного протеина С системы свертываемости крови (Лейденовская мутация). Исследуется для выявления генетической предрасположенности к тромбоэмболии, тромбозам, преэклампсии, тромбоэмболическим осложнениям во время беременности, ишемическому инсульту. Имеет прогностическое значение при приеме оральных контрацептивов и гормональной заместительной терапии.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 1q24.2
Ген F5 кодирует свертывающий фактор V (фактор Лейден), основной плазматический белок, регулирующий свертывание (коагуляцию) крови, выступая в качестве кофактора при превращении протромбина в тромбин фактором F10.
Генетический маркер F5 G1691A
Мутация гена F5 проявляется в замене гуанина (G) на аденин (А) в позиции 1691 и обозначается как генетический маркер G1691А (синонимы: фактор V Лейден, мутация Лейден, Лейденовская мутация). Следовательно, изменяются и биохимические свойства фермента, в котором происходит замена аминокислоты аргинин на глутамин.
G1691A – замена гуанина (G) на аденин (А) в позиции 1691 последовательности ДНК, кодирующей белок F5.
Arg506Gln – замена аминокислоты аргинина на глутамин в аминокислотной последовательности белка F5.
Возможные генотипы
Встречаемость в популяции
Встречаемость аллеля А составляет от 1 до 8 % в различных популяциях.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что обеспечивает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений и тромбообразования, то есть тромбофилии.
Наследственная тромбофилия (патология, обуславливающая повышенную склонность к тромбообразованию) – одно из самых распространенных генетических нарушений. Она часто остается недиагностированной и проявляется обычно в форме тромбоза глубоких вен и венозной тромбоэмболии. Нарушение свертываемости крови при наследственной тромбофилии в большинстве случаев вызывается изменениями в генах факторов свертывания крови II и V, связанными с известными генетическими маркерами (F2 G20210A, F5 G1691A). Именно они играют главную роль в развитии тромбофилии и ассоциированных с ней заболеваний.
Ген F5 кодирует свертывающий фактор V, плазматический белок, постоянно циркулирующий в неактивной форме в крови. Его активация осуществляется белком – тромбином (F2), который с помощью ионов кальция объединяет вместе тяжелую и легкую цепь фактора V. Активированный фактор V (Vа) является основным белком, регулирующим свертывание (коагуляцию) крови, выступая в качестве кофактора при превращении протромбина в тромбин фактором F10.
Замена в положении 1691 аденина на гуанин в гене F5 приводит к замещению в молекуле белка F5 аминокислоты аргинина на глутамин в положении 506. Это один из трех участков фактора V, в которых он расщепляется естественным антикоагулянтом — активированным протеином C. При таком изменении в гене фактора V (мутация Лейден) риск образования тромбов значительно увеличивается за счет отсутствия возможности негативной регуляции работы фермента. Мутация в гене F5 наследуется по аутосомно-доминантному типу, поэтому патологический эффект реализуется даже при наличии одной копии поврежденного гена.
Проявление тромбофилических генетических мутаций зависит также от возраста, факторов окружающей среды и наличия других мутаций. У носителей аллеля, предрасполагающего к тромбофилии, заболевание может не проявляться до воздействия провоцирующих факторов, таких как беременность, прием оральных контрацептивов, гормональная заместительная терапия, длительная иммобилизация, курение.
Наряду с повышенным риском тромбозов наследственная тромбофилия может увеличивать вероятность развития акушерских и гинекологических осложнений (привычное невынашивание, задержка внутриутробного развития плода, гестозы и др.).
По исследованиям Gerhardt et al. (2000), среди беременных женщин с наличием в анамнезе венозной тромбоэмболии распространенность фактора V Лейден составила 43,7 %, по сравнению с 7,7 % среди здоровых женщин.
Риск тромбоза повышается при совместном носительстве мутации в гене F5 и по генетическому маркеру MTHFR (C677T), а также при наличии 20210G-мутации в гене протромбина. Такие сочетания увеличивают риск тромбофилии в раннем возрасте и способствуют более тяжелым тромбозам.
В исследованиях Casas et al. (2004) была показана ассоциация наличия мутации Лейден с ишемическим инсультом.
С другой стороны, мутация Лейден может быть выгодной с эволюционной точки зрения. Это объясняется тем, что у женщин – носительниц этой мутации имеется такое преимущество, как сниженный риск кровотечений при родах. Таким образом, высокая распространенность потенциально вредной мутации среди населения в целом может быть результатом эволюционного отбора.
Своевременная диагностика генетической предрасположенности к повышенной свертываемости крови и ранние профилактические и/или лечебные мероприятия помогут избежать серьезных последствий для сердечно-сосудистой системы и ассоциированных тяжелых заболеваний. Кроме того, профилактика тромбоэмболических осложнений важна для безопасного течения беременности при наличии наследственной тромбофилии.
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Исследование рекомендуется проводить в комплексах:
Мутация Лейдена
Лейденовская мутация – это изменение одного или двух (гетеро-, гомозигота) участков в гене, кодирующем активность V фактора свертывания крови, проакцелерина. В результате F5 становится устойчивым к воздействию протеина С – естественного антикоагулянта, нарушаются противотромботические механизмы крови и организм находится в постоянной тромботической готовности.
Мутация Лейдена – самая распространенная причина наследственной склонности к тромбозам, инфарктам, инсультам и акушерским осложнениям у людей европеоидной расы. Патология названа в честь города Лейден (Голландия), где впервые был описан механизм ее возникновения.
Почему вы узнали о мутации Leiden только сейчас
Нечувствительность к протеину С сразу у нескольких членов одной семьи впервые выявлена шведским ученым Б. Дальбеком в 1993, а детально описана голландским профессором Р. Бертиной в 1994 году. Открытие внесло коррективы в диагностику нарушений гемостаза и акушерских осложнений – теперь любой случай тромбоза или патологии беременности в анамнезе врачи связывают с возможной тромбофилией. Согласно данным последних исследований, полиморфизм гена F5 – главная причина генетической тромбофилии у 5-8% населения Земли. Его распространенность варьируется в зависимости от региона: достигает 15% у жителей Греции, Швеции, Ливана и практически не встречается в Африке, Азии, Гренландии и отдельных районах Северной Америки.
Что такое фактор V
F5, проакцелерин, фактор Лейдена – это молекула белка, В-глобулин, которая образуется в печени человека, циркулирует в крови и участвует в каскаде свертывания.
Благодаря F5 фактор 10 прикрепляется к тромбоциту и активирует протромбин. Также проакцелерин играет важную роль в инактивации комплекса протромбиназы: в норме молекула фактора V разрушается протеином С, после чего протромбиназный комплекс распадается.
Как мутация Лейдена влияет на тромбообразование
При Leiden-мутации в клетке ДНК, кодирующей фактор 5, происходит замена белка-нуклеотида гуанина на аденин в позиции 1691 (G1691A). Изменяется порядок аминокислот в составе «готового» F5 – в 506 положении глутамин сменяет аргинин.
В результате повреждается одно из 3 мест расщепления фактора V, и он теряет чувствительность к воздействию естественного антикоагулянта, протеина С. Действие F5 длится дольше обычного, из-за чего кровь становится излишне вязкой. Нарушается система комплекса протромбиназы, высвобождается больше тромбина и возрастает риск тромбоза.
Вероятность тромбоэмболического события увеличивается с возрастом и при сочетании Лейденовской с мутациями других генов гемостаза – протромбина, протеинов С и S. В развитии тромбозов у носителей полиморфизма фактора V играет роль и ряд других факторов: беременность, прием гормонов, климактерический период, травмы, инфекционные болезни, хирургические операции.
Когда надо сдать анализ на мутацию Лейдена
| Ситуативный случай | Разъяснение |
|---|---|
| Планирование беременности | Полиморфизм F5 является причиной синдрома потери плода, тяжелых форм гестоза, случаев отслойки плаценты и ВЗР. Риск акушерских осложнений у носительниц, в зависимости от формы мутации, при беременности возрастает в 7-80 раз. |
| Прием пероральных контрацептивов, ЗГТ при климаксе | Препараты гормонов повышают уровень гомоцистеина в крови и провоцируют хроническое внутрисосудистое свертывание, что при наличии генетической предрасположенности может закончиться тромбоэмболией. |
| Рецидивирующие тромбозы у пациентов младше 50 лет | Идиопатические (причина которых не установлена), рецидивирующие, тромбозы с необычной локализацией (церебральных, брыжеечных артерий и вен) – признак того, что вы являетесь носителем тромбофилии и нуждаетесь в антикоагулянтной терапии. |
| Отягощенный семейный анамнез | Важно проследить, были ли тромбоэмболические осложнения, инфаркты, инсульты у родителей, дедушек, бабушек, братьев и сестер, поскольку Лейденовская мутация наследуется по аутосомно-доминантному типу и диагностируется у всех близких родственников. |
| Плановое хирургическое вмешательство | После любого повреждения сосудов – травмы, в ходе хирургической операции из клеток высвобождается тканевый тромбопластин, фактор III, активирующий систему свертывания крови. При отсутствии реакции между фактором 5 и протеином С, что характерно для Лейденской мутации, это служит предпосылкой для образования тромбов в венозной системе. |
Признаки и симптомы
Полиморфизм фактора 5 Leiden – генетически детерминированное заболевание. Патология присутствует у человека с рождения, но дает о себе знать только в зрелом возрасте или под воздействием «провоцирующих» факторов – травмы, длительной иммобилизации во время болезни или после операции, при наступлении беременности. До этого момента клинические проявления носительства мутации обычно отсутствуют.
Лейденская мутация – самое значимое нарушение гемостаза, приводящее организм в предтромботическое состояние. При подозрении на тромбофилию анализ на фактор V является приоритетным. В зоне особого риска находятся пациентки с рецидивирующими тромбозами и невынашиванием беременности.
Почему мутация Лейдена опасна для беременных женщин
Во время беременности в организме включается адаптивный механизм: физиологическая гиперкоагуляция, которая нарастает с каждым триместром и достигает максимума в момент родов. Так срабатывает «программа защиты» от массивной кровопотери после родоразрешения.
Но для носительницы полиморфизма гена F5 этот процесс становится патологическим и может привести к тяжелым осложнениям. Уже доказано, что мутация Лейдена – главная причина:
75% случаев невынашивания беременности, синдромов потери плода; 90% случаев ПОНРП, преждевременной отслойки плаценты; 75% случаев резкого подъема уровня артериального давления и поздних токсикозов, а также внутриутробной задержки роста плода, самопроизвольного аборта на сроках как до 12, так и до 20 недель беременности, неудач ЭКО, преждевременных родов, синдрома системного воспалительного ответа. Акушерские осложнения можно предупредить, если на этапе планирования, и даже во время беременности обратиться к квалифицированному врачу гемостазиологу, который назначит поддерживающую антикоагулянтную терапию.
Полиморфизм гена фактора V: лечится или нет
«Поправить» дефектный ген в молекуле ДНК невозможно, но гемостазиологи предлагают, как вариант, предупредить осложнения тромбофилии профилактическими мерами. Медикаментозная терапия при мутации Лейдена назначается, исходя из прогнозируемого по результатам анализа риска тромбозов:
Обследование и сопровождение пациентов с мутацией Лейдена проводят в МЖЦ на Таганской – профильной клинике под руководством Татьяны Владимировны Кузнецовой, профессоров Александра Давидовича Макацария и Виктории Омаровны Бицадзе. На базе нашей Научной лаборатории патологии гемостаза вы сможете сдать анализ на мутацию в гене FV Leiden, который позволит определить риск тромбофилии и подобрать оптимальную противотромботическую терапию.
акушер-гинеколог, гемостазиолог, профессор, доктор медицинских наук, эксперт международного уровня по проблемам тромбозов и нарушений свертывания крови
Тромбофилия лейдена что это
Этиология и встречаемость тромбофилии. Венозный тромбоз (MIM № 188050) — панэтническое многофакторное заболевание; встречаемость увеличивается с возрастом и различается в разных расах. Заболевание редкое среди азиатов и африканцев и более частое среди европеоидов.
Конкретные факторы предрасположенности — стаз, повреждения эндотелия и повышенная свертываемость крови. Выявлены генетические факторы, присутствующие у 25% всех пациентов, включая дефекты ингибиции факторов свертывания и нарушения лизиса сгустка. Фактор V Лейдена бывает у 12-14%, мутации в гене протромбина — у 6-18% и недостаточность антитромбина III или белка С или S — у 5-15% пациентов с венозными тромбозами.
Мутация Arg506Gln в гене FV, фактора V Лейдена, встречается у 2-15% здоровых в европейских популяциях; чаще всего у шведов и греков, реже у азиатов и африканцев. Фактор V Лейдена, очевидно, возник вследствие мутации у родоначальника после отхождения европеодидов от негроидов и монголоидов.
Недостаточность белка С — панэтническое заболевание с частотой 0,2-0,4%. Мутации в гене PROC обычно понижают активность белка ниже 55% нормы.
Патогенез тромбофилии
Система свертывания поддерживает точный баланс образования и ингибиции сгустка; тем не менее, если свертывание преобладает над системой ингибиции свертывания и фибринолиза, возникают венозные тромбы. Протеазы и белковые кофакторы каскада свертывания активизируются в месте повреждения, формируя сгусток фибрина, а затем должны инактивироваться, чтобы предотвратить распространение свертывания. Активированный фактор V, кофактор фактора X, ускоряет преобразование протромбина в тромбин.
Фактор V инактивируется активированным белком С, расщепляющим активный фактор V в трех местах (Arg306, Arg506 и Arg679). Первым происходит расщепление в положении Arg506, что ускоряет расщепление в двух других точках; расщепление в точке Arg506 снижает активирующую функцию фактора V, тогда как расщепление в позиции Arg306 прекращает его функцию. Белок S, кофактор белка С, ускоряет инактивацию активного фактора V белком С и усиливает расщепление в положении Arg306.
Мутация фактора V Лейдена приводит к утрате точки узнавания белком С в активном факторе V, снижая его расщепление и инактивацию и предрасполагая пациента к тромбофилии. Риск тромбофилии более высок у пациентов, гомозиготных по фактору V Лейдена; риск венозного тромбоза в течение жизни для гетерозигот и гомозигот по фактору V Лейдена составляет приблизительно 10 и 80%, соответственно.
Унаследованная недостаточность белка С возникает вследствие мутаций в кодирующей последовательности и управляющих элементах гена PROC. Большинство мутаций спорадические, хотя некоторые, например, франко-канадская мутация 3363insC, появилась в этой популяции благодаря родоначальнику. В отличие от мутации показателя V Лейдена, приводящей к усилению функции, мутации в гене PROC нарушают функцию белка С, снижая инактивацию активных факторов свертывания V и VIII и предрасполагая к образованию тромбов.
Наличие двух мутантных аллелей в гене PROC обычно приводит к молниеносной пурпуре, форме распространенного внутрисосудистого свертывания, часто фатальной, если она быстро не распознана и не предпринято лечение. Гетерозиготные мутации белка С предрасполагают к тромбофилии, увеличивая риск венозного тромбоза в течение жизни до 20-75%.
В общих чертах, для пациентов, гетерозиготных по полиморфизмам фактора V Лейдена или мутациям гена PROC, переход из состояния повышенного светрывания в венозный тромбоз требует сосуществования генетических и средовых факторов. Негенетические факторы — беременность, использование пероральных противозачаточных средств, операции, пожилой возраст, новообразования, обездвиживание и патология сердца. Генетические аномалии — различные нарушения ингибиции факторов свертывания и нарушения лизиса сгустка.
Фенотип и развитие тромбофилии
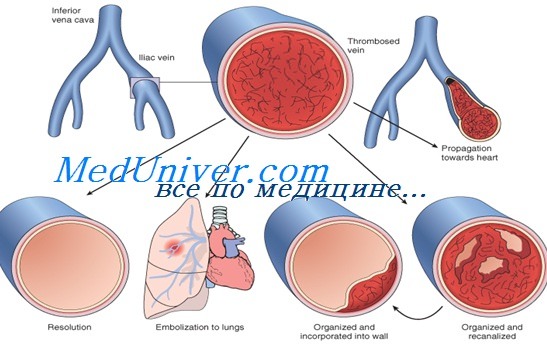
Хотя тромбы могут образоваться в любой вене, чаще они возникают в местах повреждений, в больших венозных пазухах или точках пересечения карманов клапанов в венах ног. Тромбы нижних конечностей обычно ограничены венами задней части голени, но приблизительно в 20% случаев распространяются на более проксимальные сосуды.
Перекрытие глубоких вен ноги может вызывать припухание, чувство жара, покраснение, болезненность, вздутие поверхностных вен и расширение венозных колллатералей, хотя многие пациенты не имеют симптомов.
После формирования тромб может распространяться вдоль вены и, в конечном счете, перекрывать другие вены, вызывать эмболии, удаляться за счет фибринолиза или организовываться и, возможно, реканализироваться. Эмболия — серьезное осложнение и может быть фатальной, если перекрывает артериальную систему легких; эмболия легких происходит у 5-20% пациентов, первоначально имеющих глубокий венозный тромбоз (ГВТ) (икроножных вен).
В отличие от этого, формирование тромбов проксимальных вен длительно препятствует венозному возврату и вызывает посттромботический синдром, характеризующийся болями в ногах, отеками и частым образованием кожных язв.
За исключением возможного повышения риска повторения, симптоматика, течение и исходы у пациентов с мутациями в генах PROC и фактора V Лейдена подобны другим пациентам с тромбофилией. В целом, нелеченые пациенты с тромбозом проксимальных вен имеют 40% риск повторного венозного тромбоза.
Особенности фенотипических проявлений тромбофилии:
• Возраст начала: зрелость
• Глубокий венозный тромбоз
Лечение тромбофилии
Диагноз глубокого венозного тромбоза (ГВТ) голеней труден, поскольку пациенты часто не имеют симптомов, а большинство тестов сравнительно нечувствительны, пока тромб не распространится проксимальнее в глубокие вены икр. Чаще всего для диагностики глубокого венозного тромбоза (ГВТ) используют дуплексную ультрасоногра-фию вен; тромб обнаруживают или прямым визуальным наблюдением, или логически, если вена не сужается при сжатии. Допплеровское УЗИ позволяет обнаружить аномальный кровоток в венах.
Фактор V Лейдена может быть диагностирован непосредственно анализом ДНК или может быть заподозрен на основе определения активного белка С. Недостаточность белка С диагностируют измерением его активности; мутации в гене PROC определяют прямым анализом гена.
Лечение в остром периоде нацелено на снижение распространения тромба и сопутствующих осложнений, особенно эмболии легких; обычно оно включает антикоагулянты и возвышенное положение пораженной конечности. Последующая терапия сфокусирована на предотвращении повторного венозного тромбоза путем выявления и улучшения предрасположенности и профилактики свертывания крови. Рекомендации по лечению больных с недостаточность белка С и фактора V Лейдена продолжают разрабатывать.
Все они должны получать стандартную стартовую терапию противосвертывающими препаратами, по крайней мере, в течение 3 мес. Остается неясным, насколько долго должны получать лечение антикоагулянтами пациенты с единственным мутантным аллелем, но больным с повторным случаем венозного тромбоза обычно показан продолжительный, возможно пожизненный, прием антикоагулянтов.
В отличие от этого, гомозиготные пациенты по фактору V Лейдена, а также гомозиготы по другим мутациям или сложные гетерозиготы (как приведенный в примере пациент) нуждаются в продолжительном приеме антикоагулянтов уже после первого эпизода.
Риски наследования тромбофилии
Каждый ребенок у семейной пары, если один из родителей гетерозиготен по фактору V Лейдена, имеет 50% риск унаследовать мутантный аллель. При 10% пенетрантности каждый ребенок имеет 5% риска развития венозного тромбоза в течение всей жизни.
Каждый ребенок у семейной пары, если один из родителей гетерозиготен по мутации PROC, также имеет 50% риск унаследовать мутантный аллель. Оценка пенетрант-ности недостаточности белка С колеблется от 20 до 75%; следовательно, каждый ребенок имеет 10-38% риска развития венозного тромбоза в течение жизни.
Из-за неполной пенетрантности и доступности эффективной терапии для гетерозиготных носителей фактора V Лейдена и мутаций PROC, пренатальную диагностику проводят редко, за исключением необходимости обнаружения гомозиготных или компаундных гетерозиготных мутаций в гене PROC. Пренатальное обнаружение гомозигот или компаундных гетерозигот по мутациям PROC полезно вследствие тяжести болезни и быстрой потребности в лечении в периоде новорожденности.
Пример тромбофилии. У Ж.Ж., 45-летнего бизнесмена франко-шведского происхождения, на следующий день после перелета через Тихий океан внезапно развилась одышка. Его правая нога распухла и была горячей на ощупь. Последующие исследования выявили тромб в подколенных и подвздошных венах и эмболию легочных вен. У родителей Ж.Ж. отмечали венозные тромбозы ног, а сестра умерла от легочной эмболии во время беременности. Основываясь на возрасте Ж.Ж. и семейном анамнезе, врач заподозрил у него наследственную склонность к тромбофилии.
Скрининг на наследуемые причины тромбофилии выявил, что пациент — носитель мутации Лейдена фактора V. Последующие исследования других членов семьи идентифицировали ту же мутацию в гетерозиготном состоянии у его отца, умершей сестры и здорового старшего брата. Кроме того, сам пациент, его мать, скончавшаяся сестра и здоровая старшая сестра оказались гетерозиготными по мутации сдвига рамки (3363insC) в гене PROC, кодирующем белок С. Таким образом, пациент оказался двойной гетерозиготой в двух различных генах, предрасполагающих к тромбозу.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Тромбофилия лейдена что это
Занимают третье место по частоте сердечно-сосудистых заболеваний и возникают при нарушении кровообращения (застоий крови), повреждении эндотелия сосудистоий стенки, повышенноий способности крови к образованию тромба (гиперкоагуляция и ингибирование фибринолиза), а также при сочетании этих причин.
Вероятность венозного тромбоза может многократно увеличиваться при наличии у больного наследственной или приобретенной тромбофилии.
Тромбофилия – хроническое состояние организма с тенденцией к спонтанному образованию тромбов в сосудах или к бесконтрольному распространению тромбов за пределы поврежденного участка.
Тромбофилия является потенциально опасным состоянием для людей любого возраста, поскольку может приводить к развитию тромбоза, инфаркта или инсульта в молодом возрасте, а также повышает риск осложнений и невынашивания беременности у женщин.
Механизм тромбообразования
Какая же роль образования тромбов?
Для чего они нужны?
В организме человека, при нормальном его функционировании, поддерживается постоянство внутренней среды, что называется гомеостазом.
Одним из факторов гомеостаза является и тромбообразование, что необходимо для сохранения крови в жидком состоянии и формирования гемостатической «пробки», которая закрывала бы поврежденный сосуд при патологическом процессе или травме, таким образом предотвращая потерю крови. Но следует учесть, что формирование гемостатической пробки не должно препятствовать кровоснабжению определенного органа.
Существует также и другая система, которая препятствует чрезмерному тромбообразованию и способствует рассасыванию тромбов. Совместное «правильное» функционирование этих систем поддерживают нормальные процессы гемостаза в организме человека.
Если же возникает сбой в системе гемостаза, то развиваются тромбофилии, которые могут вызвать тромбоз органов, закрывая просвет сосудов тромбом.Поэтому тромбофилия является потенциально опасным состоянием для людей любого возраста.
Факторы этого патологического состояния связаны, в первую очередь, с нарушением активности гемостатических белков (антикоагулянтов, прокоагулянтов), а также с разнообразными аномалиями в развитии сосудов.
Формы тромбофилии
Существует две формы тромбофилии: наследственная и приобретенная.
Наследственные формы тромбофилии могут быть обусловлены полиморфизмами в генах кодирующих аминокислотную последовательность белков:
F2 протромбина, F5 коагуляционного фактора 5 (фактора Лейдена) и некоторых других.
Мутации этих генов часто встречаются в сочетании друг с другом. Хотя под термином «тромбофилия» и подразумевают генетически обусловленное состояние, но выделяют и приобретенные состояния с повышенной склонностью к образованию тромбов.
К приобретенным факторам риска
формирования тромбов можно отнести:
Но основную группу составляют все-таки
наследственные факторы риска образования тромбов.
К наследственным тромбофилиям относятся
следующие состояния :
Диагностика наследственной тромбофилии
Диагностика наследственной тромбофилии включает в себя комплекс лабораторных тестов: исследование генетических полиморфизмов в генах гемостаза (F2, F5, F7, F13A1, FGB, PAI-1, ITGA2-a2, ITGB3-b) и в генах фолатного цикла (MTHFR, MTR, MTRR), оценка показателей коагулограммы (протромбин, МНО, АЧТВ, фибриноген, тромбиновое время), определение уровня антитромбина III, протеинов C и S, гомоцистеина и волчаночного антикоагулянта.
Полиморфизм бывает двух видов: гомозиготный и гетерозиготный.
Первый очень «серьезный» вариант, ведь в таком случае человек имеет два доминантных или рецессивных гена, которые отвечают за проявление тех или иных признаков.
Второй вариант полиморфизма менее «серьезный», но указывает на носительство «неблагоприятного», в развитии заболевания, признака. И не стоит думать, что это все мутации, ведь такой вариант в строении гена может представлять и естественную вариацию. Поэтому определив вариацию генного полиморфизма, можно повлиять на эффективность лечения и профилактику возможных тромботических осложнений.
Показания к анализу на
полиморфизм генов
Важные в развитии генетической
тромбофилии полиморфизмы:
F2 c.*97G>A (p.20210 G>A; rs1799963)
F2 или протромбин в системе свертываемости крови входит в перечень одного из главных ее компонентов.
Ген F2 кодирует аминокислотную последовательность белка протромбина. В процессе расщепления протромбина образуется тромбин, который необходим для формирования кровяного сгустка. Полиморфизм F2 p.20210 G>A приводит к увеличению экспрессии гена F2, в результате чего уровень протромбина становится в несколько раз выше нормы. Мутация имеет аутосомно-доминантный тип наследования, соответственно тромбофилией страдает даже гетерозиготный носитель измененного гена (G>A). Носители А варианта полиморфизма обладают большим риском летального случая в периоде после операции, а также во время лечения новообразований и других болезней, без учета генетической склонности человека к тромбозу.
Гетерозиготными носителями, по данным статистики, являются около 3% людей европеоидной расы.
Клинически данный полиморфизм проявляется необъяснимым бесплодием, гестозами во время беременности и состоянием преэклампсии, преждевременной отслойкой плаценты, невынашиванием беременности, фетоплацентарной недостаточностью, задержкой внутриутробного развития плода или даже его гибелью; венозными и артериальными тромбозами и тромбоэмболией, нестабильной стенокардией, инфарктом миокарда.
F5 с.1691G>A (p.Arg506Gln; rs6025)
Функция этого фактора заключается в активации перехода протромбина в тромбин. При полиморфизме данного гена в 1691 позиции (Лейденовская мутация) заменяется нуклеотидное основание гуанина на аденин, что приводит к замене аргинина на глутамин в положении 506 и повышенной устойчивости активной формы проакцелерина. Таким образом, активная форма фактора Лейдена вызывает гиперкоагуляцию крови и приводит к рецидивирующим венозными тромбозами и тромбоэмболиям. Распространенность мутации этого гена среди европеоидной расы составляет до 6%.
Клинически полиморфизм F5 c.1691G>A (p.Arg506Gln) проявляется тромбоэмболиями, инфарктом миокарда, инсультами. Также представляет угрозу при беременности, усложняя ее течение, и может спровоцировать не только выкидыш на ранних сроках, но и повлиять на развитие плода, вызвая его отставание.
Пациенты, являющиеся одновременно носителями полиморфизма c.*97G>A гена протромбина и «мутации Лейдена» в гене F5, в большей степени подвержены риску развития тромбозов и тромбоэмболий и нуждаются в тщательном наблюдении и лечении.
PAI-1 (SERPINE1) c.–675 5G>4G (rs1799889)
Ген ингибитора активатора плазминогена (PAI-1) кодирует белок-антагонист тканевого и урокиназного активатора плазминогена и является важным компонентом противосвертывающей системы.
Мутации в данном гене приводят к снижению активности противосвертывающей системы, повышая риск кровотечений.
Распространенность полиморфизма среди людей европеоидной расы составляет от 5 до 8%.
Последние исследования показали, что три вышеперечисленных полиморфизмы имеют наибольший эффект на систему свертывания крови и подлежат глубокому изучению.
F7 c.10976 G>A (p.Arg353Gln; rs6046)
При активации фактора VII происходит его взаимодействие с III фактором, активизируя при этом IX и X факторы системы гемостаза. Таким образом, коагуляционный фактор VII принимает непосредственное участие в образовании кровяного сгустка. При наличии варианта p.353Gln понижается экспрессия гена VII фактора, что обладает протективным свойством в процессе развития инфаркта миокарда и тромбозов.
Распространенность такого варианта среди лиц европейской популяции составляет от 10 до 20 %.
F13 с.103G>T (p.I63Т; rs5985)
Фактор свертываемости крови 13 (F13) представляет собой фермент, отвечающий за последнюю стадию в процессе коагуляции крови. Этот фактор является плазменным гликопротеином, который циркулирует в крови. Кроме основной функции во время свертывания крови, данный фактор еще и стабилизирует клеточную поверхность мембран.
Распространенность в европейской популяции составляет около 20%.
Распространенность мутации данного гена среди европейской популяции составляет от 5 до 10%.
ITGA2 с.807C>T (p.Phe224Phe; rs1126643)
Ген ITGA2 отвечает за кодирование аминокислотной последовательности а2-субъединицы специализированных тромбоцитарных рецепторов (интегринов), благодаря которым тромбоцит взаимодействует с белками тканей во время повреждения сосудистой стенки. Благодаря своим рецепторам, тромбоциты могут образовать в области повреждения монослой, что является важным условием в активации следующих компонентов в цепной реакции свертывания крови, из-за которой организм предохраняется от обильных кровопотерь.
Частота встречаемости данного полиморфизма составляет от 5 до 7%.
При наличии нуклеотидной замены цитозина (С) на тимин (Т) в позиции 807 данного гена, изменяются свойства рецепторов тромбоцитов, увеличивается скорость их склеивания, что приводит к повышению риска возникновения тромбофилии.
ITGB3 с.1565T>C (p.Leu33Pro; rs5918)
ITGB3 – это тромбоцитарный рецептор фибриногена. Его также называют гликобелком-3а (GPIIIa), он участвует в процессах сигнализации и межклеточной адгезии. Именно этот белок обеспечивает взаимосвязь между тромбоцитом и фибриногеном, который содержится в плазме крови, вследствие чего происходит быстрая агрегация (склеивание) тромбоцитов, и закупорка поверхности поврежденного эпителия. Распространенность – от 8 до 15%.
Полиморфизм в ITGB3 вызывает повышенную склонность тромбоцитов к склеиванию, а это, в свою очередь, повышает риск возникновения заболеваний сердечно-сосудистой системы. Часто у людей, при таком полиморфизме, отмечается снижение эффективности действия аспирина, как тромболитического средства.
Распространенность мутации ITGB3: 1565 T>C (Leu33Pro) в европейской популяции – от 8 до 15%.
Важно также отметить, что данная нуклеотидная замена усугубляет влияние других полиморфизмов (к примеру, мутации Лейден).
Таким образом, диагностика тромбофилий крайне важна и помогает правильно назначить терапию, провести профилактику венозных тромбоэмболических осложнений, а также определиться с тактикой ведения беременности.
Заказать анализ генетических полиморфизмов, ассоциированных с риском тромбообразования можно можно в Медико-генетическом центре «Геномед».
Стоит отметить, что вероятность развития осложнений при беременности увеличивается в сочетании с полиморфизмами в генах фолатного цикла (MTHFR, MTR, MTRR), в связи с чем лучше всего их рассматривать в комплексе
Стоимость 6 900 рублей
Срок выполнения 10 дней
Заказать исследования
Заболевания, ассоциированные
с повышенным тромбообразованием
Нарушения в свертываемости крови являются одной из причин осложнений во время беременности. Имея в основе разные факторы, она сгущается и двигается по сосудам, замедляя скорость. А это в свою очередь, может вызвать образование тромбов, которые закупоривают сосуды и приводят к тяжелым последствиям.
Такие нарушения в свертываемости крови приводят к тому, что у женщины не приживается в матке плодное яйцо, происходят нарушения в плаценте, либо регулярные выкидыши на ранних сроках.
И причиной этому является антифосфолипидный синдром – это клинический иммунный симптоматический комплекс, характеризующийся тромбозами венозного и артериального характера, последствиями которого является потеря плода с неясным генезом.
Этот синдром может развиваться и имея в основе генетическую предрасположенность.
В организме человека произошло мутирование определенных генов, которые отвечают за свертывание крови. А потом эти нарушения из поколения в поколение передаются по наследству.
Чаще всего это обнаруживается при определенных ситуациях – беременность, операция, травма или прием гормонов. То есть при тех обстоятельствах, когда свертываемость крови увеличивается. Это хорошая почва на которой проявляется неблагоприятная наследственность.
Антифосфолипидный синдром при беременности провоцирует появление тромбозов в несколько раз.
Соответственно, повышается вероятность невынашивания плода. Однако это не означает, что женщинам с проблемой свертывания крови нельзя помочь. Современная медицина имеет возможность провести тщательную диагностику таких нарушений. По ее результатам можно провести отбор женщин в потенциальную группу риска. А затем приложить максимум усилий, чтобы свести на нет проявления антифосфолипидного синдрома и беременность сделать максимально безопасной, исключить возможность осложнений.
Будущей маме придется произвести корректировку образа жизни, питания и начать прием назначенных препаратов.
Прием таких лекарств необходим на протяжении всего срока беременности, особенно тем, у кого были случаи невынашивания беременности. Обязательной диагностике особенно должны подлежать женщины, если у них рождались мертвые младенцы или они вскоре умирали.
Если есть осложнения, которые связаны с антифосфолипидным синдромом, и беременность планируется в ближайшее время, в таких случаях за месяц до ее наступления необходимо начать прием противотромботических препаратов, назначенных врачом. И не прекращать лечение в течение всего периода положения беременности. Тогда шансы на благополучный исход очень велики, ведь правильное и своевременное лечение дает эффективность почти 100%!
Термин «Тромбоз» используется для обозначения появления сгустков в сосудистой системе. Чаще всего встречается тромбоз вен.
Тромбоз – серьезное заболевание, которое может привести к сердечной недостаточности (коронарный тромбоз), инсульту или гангрене, если он поразит кровеносные сосуды конечностей.
Острый тромбоз требует срочного врачебного вмешательства. Вызовите «скорую помощь» или вашего домашнего врача. Положите пациента поудобнее, обеспечьте ему тепло. Не давайте пациенту никакой еды и питья. Не разрешайте ему двигаться до тех пор, пока не придет помощь.
Никаких средств альтернативной медицины применять нельзя, пока не получено заключение врача. Длительное наблюдение за состоянием и профилактика возможного в будущем тромбоза зависит от правильного питания, физических упражнений, снижения потребления алкоголя и табака. Излишний вес также является фактором риска.