за что отвечает ген арое
Ген APOE и коронавирусная инфекция
26 мая в Журнале геронтологии вышла статья, в которой говорится, что у людей с определенным вариантом гена APOE новая коронавирусная инфекция COVID-19 протекает тяжелее, чем у других.
Мы решили разобраться, так ли это и стоит ли верить этому исследованию.
Что мы знаем про ген APOE
Ген APOE дает инструкции по созданию белка, который вместе с жирами образует липопротеины. Они отвечают за упаковку холестерина и других жиров и их перенос в кровотоке от одних органов к другим.
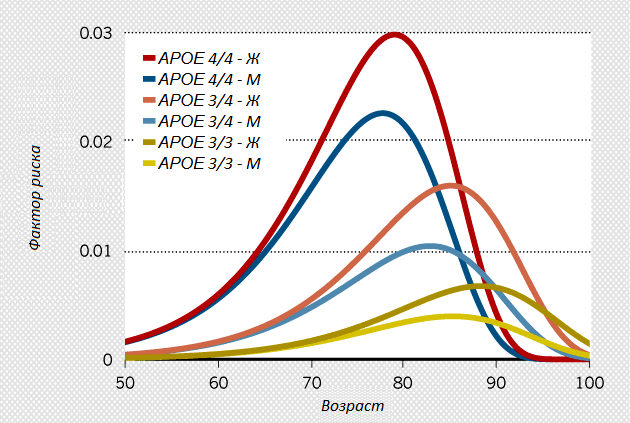
Ген APOE связывают с риском развития болезни Альцгеймера. Согласно мета-анализу, в котором собрали все исследования на эту тему, люди с вариантом e4 этого гена имеют гораздо большую вероятность заболеть, чем люди с другими вариантами.
Образовательный блок
У каждого гена существует несколько вариантов. Это делает человека уникальным и отличным от других людей. Ген APOE находится на 19 хромосоме, которых в норме 2 копии — по одной от каждого родителя. Две копии этого гена могут иметь разные варианты, например на одной е3, на другой — е4. А могут и одинаковые — е4/е4. Наиболее распространенный вариант гена APOE — е3, далее идет е4, а затем е2.
Люди, которые унаследовали одну копию варианта е4 гена APOE, имеют повышенный риск развития заболевания. Однако те, кто унаследовал две таких копии (е4/е4), подвергаются еще большему риску. В генетическом тесте Атлас мы исследуем вариант гена APOE для подсчета риска развития болезни Альцгеймера.

Гид по результатам Генетического теста Атлас
Что касается COVID-19, пока нет оснований утверждать, что варианты гена APOE влияют на тяжесть течения коронавирусной инфекции.
Что не так с новым исследованием
К методам исследования и его результатам есть несколько серьезных замечаний. Придется немного вспомнить статистику, но мы постараемся объяснить подробно и понятно.
Эксперты Атласа считают, что такой порог должен применяться для всех генетических исследований, а не только полногеномных. Дмитрий Никогосов, врач-генетик, биоинформатик, руководитель отдела аналитики Атлас:
Неверный дизайн исследования
Исход исследования во многом зависит от того, как оно было спроектировано: какие группы людей участвовали, какие критерии включения использовались, как происходил анализ данных. В данном случае, мы обратили внимание на критерии, по которым исследователи относили людей к группам с легко и тяжело протекающим COVID-19.
Исследование было проведено на данных британского биобанка (UK Biobank). Это большая база данных с информацией о диагнозах, анализах и генетике для 500 000 человек. 16 апреля 2020 года биобанк разослал всем научным группам и организациям, которые сотрудничают с ними, данные с результатами теста на SARS-CoV-2 — возбудителя COVID-19. Данные были только для 1 474 человек из 500 000.
Исследователи изучали связь между вариантом гена APOE и вероятностью положительного теста на коронавирусную инфекцию, но не связь с легкой или тяжелой формой.
Мы знаем эти подробности, потому что сотрудничаем с биобанком и анализировали новые данные по COVID-19. Расскажем об этом подробнее после публикации нашей статьи в научном журнале. Из 1 474 протестированных на вирус людей тест показал положительный результат примерно у половины.
Для повышения качества данных авторы ввели дополнительные критерии для отбора и оставили для исследования 622 человека. Их исследователи отнесли в группу тяжелого течения инфекции. Остается сформировать вторую группу с легкой формой инфекции, чтобы сравнить генетические различия между группами и найти те, которые связаны с тяжестью течения.

Как интеллект передается по наследству
Британский биобанк предупреждает на сайте о том, что положительные результаты тестов не обязательно указывают на тяжелое заболевание, так как тестирование стало широко доступным. Для людей с легкой формой в том числе. Они также указывают, что для оценки тяжести заболевания следует использовать данные медицинских карт, а не только результаты тестов.
4 июля авторы исследования выпустили новую работу о связи вариантов гена APOE и смертностью от коронавирусной инфекции. Они использовали тот же дизайн исследования и подвердили связь.
Как должно выглядеть исследование
На взгляд наших экспертов, чтобы получить данные для каких-либо однозначных выводов, необходимы следующие шаги:
Журнал геронтологии опубликовал комментарий с замечаниями по исследованиям нашей научной команды. Мы надеемся, что наша работа поможет ученым оценить результаты научной статьи с разных сторон.
С тяжестью протекания коронавирусной инфекции и смертностью пока достоверно не связан ни один генетический вариант. Во всяком случае надежных публикаций на эту тему наши эксперты не нашли.
Болезнь Альцгеймера: ген, от которого я без ума
Болезнь Альцгеймера, настигающая большинство людей в старости, является одной из самых острых проблем здравоохранения
Автор
Редакторы
В начале XX века с помощью немецкого психиатра Алоиса Альцгеймера мир узнал о существовании новой нейродегенеративной болезни. И хотя долгое время исследователи не воспринимали генетическую предрасположенность в качестве важного фактора для развития болезни Альцгеймера, вскоре ситуация изменилась. Однако и сейчас о природе этого заболевания идут ожесточенные споры: кто же во всем виноват — β-амилоид или APOE4?
Бета-амилоид, образующий при болезни Альцгеймера нерастворимые бляшки в нервных клетках, традиционно считался основной причиной нейротоксичности при этом заболевании, однако в действительности дело обстоит не так просто. В частности, токсичными могут быть не только фибриллярные, но и промежуточные сферические агрегаты Aβ (см. «Альцгеймеровский нейротоксин: ядовиты не только фибриллы» [14]), на вероятность развития БА положительно влияет недосып (см. «Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска» [15]), ну а на сладкое — в реальности бета-амилоид может быть вообще не нейротоксином, а компонентом врождённого иммунитета в нервной системе человека (см. «Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета» [16]). — Ред.
Профессор Роузес сразу понял, что его коллега нашел нечто важное. Двумя годами ранее ими было обнаружено, что экспрессия некоторых генов из хромосомы 19 способствует развитию деменции, а поскольку Роузес знал, что ген, кодирующий ApoE, также находится на этой хромосоме, его молниеносно осенила идея участия ApoE в развитии болезни Альцгеймера (БА).
В организме человека есть три варианта гена APOE, кодирующих изоформы белка Е2, Е3 и Е4, и Роузес решил выяснить их влияние на развитие болезни Альцгеймера. Для определения отдельных аллелей нужно было провести полимеразную цепную реакцию (ПЦР) [17]. Так как ученый имел весьма скромный опыт работы с ПЦР, он хотел привлечь в свою команду нейрофизиологов, но получил отказ: хотя они и были заняты охотой за генами, которые лежат в основе болезни Альцгеймера, АРОЕ показался им неподходящим кандидатом. Роузес вспоминает, как позже в лаборатории ходили разговоры: «. начальник совсем потерял голову от своих безумных идей».
Но Роузес не сдавался. Он попросил помощи у своей жены, генетика Энн Сондерс (Ann Saunders), которая использовала ПЦР в своих исследованиях. Она только что родила дочь и была в декретном отпуске, и потому они заключили соглашение. «Она сделала все эксперименты, пока я присматривал за ребенком», — говорит профессор. В течение трех недель супруги собрали данные, которые в дальнейшем легли в основу серии знаковых публикаций. Они выяснили, что аллель APOE4 способствует развитию БА [1].
Сегодня, двадцать лет спустя, APOE4 остается ведущим фактором риска для наиболее распространенной формы деменции. Наследование одной копии APOE4 вчетверо повышает риск возникновения заболевания, двух копий — в 12 раз (рис. 1). Однако данные Роузеса в основном не воспринимали всерьез или критиковали. Впоследствии, даже когда мнение об ApoE поменялось, большинство ученых все равно продолжали работать с β-амилоидом, как бы «зациклившись» на классике. Но некоторые лаборатории все равно исследовали ApoE, несмотря на равнодушие финансирующих учреждений и научного сообщества и на отсутствие ресурсов, необходимых для проведения масштабных экспериментов.
Рисунок 1. Носители аллеля APOE4 более подвержены развитию болезни Альцгеймера по сравнению с теми, кто унаследовал две копии аллеля APOE3
Долгое время было неизвестно, какие функции белок ApoE выполняет в головном мозге, и постепенно эта головоломка стала интересовать многих нейрофизиологов. Интерес к липопротеинам продолжал расти, — отчасти потому, что клинические испытания лекарств, нацеленных на β-амилоид, часто заканчивались неудачей. Многие исследователи начали скрупулезно изучать белок ApoE4 и, как следствие, привлекли внимание фармацевтических компаний. «Амилоидные подходы» постепенно перестали использовать, зато начали разрабатывать препараты, направленные на аполипопротеин.
«Несмотря на отсутствие уверенных доказательств, амилоидная гипотеза стала в свое время сильным научным постулатом», — говорит Завен Хачатурян, президент некоммерческой компании «Предотвратим Болезнь Альцгеймера» (Prevent Alzheimer’s Disease 2020) и бывший координатор деятельности, связанной с исследованием БА в Национальных институтах здоровья США. До недавнего времени, по его словам «никто не пытался задать фундаментальный вопрос — правильно ли мы определили основную предпосылку болезни?».
Жесткая конкуренция
Существуют разные доводы относительно того, почему открытие Роузеса было проигнорировано. Многие сходятся во мнении, что генетик выбрал неудачное время для обнародования своих результатов. В 1991 году Джон Харди (John Hardy) и Дэвид Олсоп (David Allsop) предложили «гипотезу амилоидного каскада». Они утверждали, что болезнь Альцгеймера является результатом аномального накопления β-амилоидных бляшек в тканях мозга [3]. Научное сообщество поддержало предложенную идею, которую вскоре начали активно финансировать.
Но Роузес не подписался под этой теорией: «. амилоиды являются одними из многих веществ, которые формируют бляшки; в конечном итоге они разрушают клетки и вызывают атрофию мозга. У меня и мысли не было, что это было причиной деменции». Говоря так, он, возможно, хотел скрыть возможную связь ApoE/Аβ, и случайно создал конкуренцию между двумя гипотезами за финансирование. К сожалению, Роузес так и не получил гранты для работы с ApoE.
Были и технические препятствия для изучения ApoE. Белок входит в состав различных липопротеинов плазмы крови и является довольно сложной фармакологической мишенью при работе с головным мозгом. ApoE имеет липофильную часть и поэтому при биохимическом анализе может агрегировать с другими молекулами. Работа с такими белками требует глубокого понимания биохимии липопротеинов и методик работы с ними.
Три оставшихся препарата, которые нацелены на β-амилоид, в настоящее время проходят испытания на больных, а также на людях с высоким риском БА, у которых еще не развились симптомы. Позитронно-эмиссионная томография показала, что мозг подопытных с высоким риском развития БА отличается от здорового мозга за десятилетия (!) до того, как начинает накапливаться β-амилоид или разрушаться нейроны [4]. В результате исследований, которые будут проводиться в течение следующих шести лет, ученые поймут, способны ли данные лекарства отсрочить наступление заболевания или нет. Среди исследователей и представителей фармацевтической индустрии появилось ощущение, что это — последний шанс для амилоидной гипотезы. На фоне этих сомнений ApoE вновь оказался в центре внимания.
По словам Мака, если испытания закончатся неудачей, ученые будут отчитываться перед инвесторами, предоставляя все данные доклинических и ранних клинических испытаний. Он надеется, что исследователи АроЕ вскоре получат большое преимущество. Несмотря на препятствия в этой области, у ученых продолжает крепнуть подозрение, что именно ApoE4 является предпосылкой для возникновения болезни. Этот факт подтверждают группы Мака и Гольцмана (Holtzman) в опытах на трансгенных мышах, которые несут в себе изоформы ApoE человека.
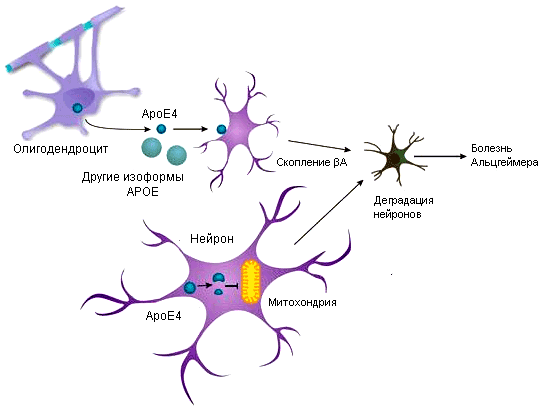
Скорее всего, ApoE участвует в развитии БА двумя различными путями, один из которых — амилоид-зависимый. И у животных, и у человека ApoE4 способствует отложению Aβ в мозговом веществе, в то время как ApoE3 считается «нейтральной» изоформой, а ApoE2 — «защитной» формой, уменьшающей накопление бляшек [5]. «Это достаточно убедительные данные», — говорит Хольцман.
Другой механизм не предусматривает взаимосвязи с амилоидом. Когда нейроны находятся в состоянии стресса, они экспрессируют ApoE для своего восстановления. «Плохая» форма — ApoE4, — как правило, разрушается на токсичные фрагменты, которые повреждают митохондрии и модифицируют цитоскелет.
Рисунок 2. Две расходящиеся гипотезы о том, как АроЕ способствует болезни
Оценить вклад этих двух механизмов в риск развития болезни Альцгеймера крайне сложно, говорит Хольцман, но он и его коллеги считают, что трансформация вредоносной изоформы ApoE в «нейтральную» может стать перспективным подходом для лечения БА. В Гладстоне исследователи начали изучать этот вопрос, и уже найдены небольшие регуляторные молекулы, которые трансформируют ApoE4 в ApoE3-образный белок и тем самым снижают аномальную фрагментацию первого [7]. В культуре клеток даже низкие концентрации этих молекул могут уменьшить разрушение митохондрий и дисфункцию нейронов [8]. В настоящее время эти молекулы проходят испытания на животных, и если они в конечном счете окажутся безопасными и эффективными, врачи будут назначать их пациентам, предрасположенных к БА, так же, как статины — больным с высоким уровнем холестерина и с повышенным риском сердечно-сосудистых заболеваний.
Более чем достаточно
Несмотря на отсутствие грантов на исследования ApoE, Роузес никогда не сдавался. Но через несколько лет, когда его группа обнаружила связь между ApoE и болезнью Альцгеймера, он устал от постоянного денежного противостояния и оставил науку. Проработав в фармацевтической индустрии десять лет, в течение которых он не переставал исследовать ApoE, в 2008 году он снова возвращается в Дьюковский университет.
В 2009 году его группа описала участок некодирующей ДНК с геном TOMM40, который располагается рядом с APOE на девятнадцатой хромосоме. Этот участок ДНК (сокращенно — 523) варьирует по длине и, в зависимости от этого, может определять уровень экспрессии генов TOMM40 и АРОЕ [9].
По словам Роузеса, это было важное открытие, так как белок, кодируемый геном TOMM40 — Tom40, — является необходимым для «здоровых» митохондрий. Tom40 образует канал во внешней митохондриальной мембране, через который импортируются белки, необходимые для нормального деления этой органеллы. «Мы знали о существовании такого механизма в течении 10 лет, — говорит ученый, — но то, что он приводит к болезни Альцгеймера, мы и не подозревали».
Роузес продолжал утверждать, что участок 523 можно использовать для разработки терапии и более точного предсказания болезни. Подавляющее большинство людей рискует встретиться со своим Альцгеймером, если только проживет достаточно долго, а ведь носителями аллеля APOE4 являются только 25% населения. Значит, тест на носительство этого аллеля никогда не будет до конца точным предиктором. Но генотипирование по обоим генам — АРОЕ и TOMM40 — может существенно увеличить точность, как говорит Роузес. В его лаборатории открыли, что APOE3 — наиболее частая изоформа — обычно наследуется вместе или с коротким, или с очень длинным участком 523. И у носителей двух аллелей APOE3 возраст наступления заболевания будет зависеть от конкретного варианта участка 523, наследуемого вместе с APOE.
Некоторым лабораториям удалось найти доказательства, подтверждающие гипотезу Роузеса, однако у других повторить исследования на TOMM40 так и не удалось, и возникли сомнения в реальности влияния этого гена на риск развития БА [10]. Однако Роузес не сомневается в правильности своих гипотез и считает, что геномные исследования, не подтвердившие его результатов, обладали недостаточной силой для выявления сцепливания TOMM40 и болезни Альцгеймера.
Роузес надеется, что вскоре он сможет подкрепить свои результаты клиническими исследованиями, которые будут проводиться в основанной им компании Zinfandel Pharmaceuticals. Вместе с японской фармацевтической компанией Takeda Зинфандель в настоящее время финансирует фазу III клинических испытаний (под названием TOMMORROW), призванную проверить идеи Роузеса на деле. TOMMORROW должна оценить риски развития БА в зависимости от возраста пациента и вариантов APOE и TOMM40. Для запуска программы будут отобраны около 6000 здоровых пожилых людей, и исследования будут продолжаться около 5 лет.
Программа будет также исследовать возможность того, что пиоглитазон — препарат для лечения пациентов с сахарным диабетом 2 типа, — в малых дозах будет задерживать развитие БА у лиц, отнесенных к группе высокого риска развития болезни Альцгеймера. Проверка этой идеи вызвана тем, что опубликованы результаты опытов на животных и даже на людях, которые говорят о способности пиоглитазона предотвращать или уменьшить патологию и симптомы, связанные с болезнью Альцгеймера [11]. Роузес думает, возможный механизм этого — стимуляция деления митохондрий.
Даже если получить мощное лекарство против болезни Альцгеймера так и не удастся, толк в этих испытаниях все равно будет: научившись задерживать развитие БА хотя бы на два года, можно уменьшить число больных в США через 50 лет на 2 млн. человек, что очень и очень неплохо [12]. Кроме того, результаты этих испытаний заставят исследователей всего мира по-новому взглянуть на деменцию. Такое сложное расстройство, как болезнь Альцгеймера, нельзя изучать только с одной стороны, — пусть и включающей ApoE4 или еще что-нибудь. По-видимому, нейрофизиологи близки к тому, чтобы признать ограниченность своих прежних взглядов и частично пересмотреть их, направив исследования по новым дорожкам, в конце которых будет разгадка проблемы, лишающей нас ума.
По материалам рубрики News Feature в Nature [13].
Ген аполипопротеина Е (APO E)
Исследование аллельного полиморфизма гена ApoE имеет прогностическое значение, позволяющее определить риск развития ишемической болезни сердца вследствие нарушения липидного обмена.
Ген ApoE кодирует аминокислотную последовательность белка aполипопротеина Е. Aполипопротеин Е синтезируется в печени и головном мозге, и играет существенную роль в метаболизме липидов. Aполипопротеин Е входит в состав жировых частиц хиломикронов и липопротеинов очень низкой плотности (ЛПОНП), инициируя их захват и удаление из крови через взаимодействие со специфическим рецептором на поверхности клеток печени. АроЕ участвует в некоторых других процессах, таких как иммунорегуляция, нервная регенерация и активация некоторых липолитических ферментов (липазы печени, липазы липопротеинов и лецитин-холестерин ацилтрансферазы). Он необходим для доставки холестерина от глиальных клеток мозга до нейронов. Эффективность взаимодействия ApoE с рецепторами определяется уникальным строением белковой молекулы.
Выделяют три изоформы ApoE: Е2, ЕЗ, Е4, которые определяются аллельным полиморфизмом (разнообразием) гена АpoЕ. Аллельный полиморфизм гена ApoE обусловлен заменой по двум аминокислотным остаткам, что приводит к изменению биологических свойств aполипопротеина Е.
Вариант Е3 является наиболее распространенным. Частота аллеля в Европейской популяции составляет 70-80%.
Вариант Е2 в гетерозиготном состоянии связан со снижением уровней холестерина и бета-липополипротеинов в сыворотке крови. Частота этого варианта выше у долгожителей. В гомозиготном состоянии аллель Е2 встречается в популяции с частотой около 1%. Обычно у лиц, гомозиготных по аллелю Е2 голодовой гиперлипидемии не выявляется, но увеличение липидов плазмы крови становится значительным после приема пищи. Приблизительно у 1 из 50 носителей сочетания Е2//Е2 развивается голодовое увеличение уровня липидов, характерное гиперлипопротеинемии III типа.
Вариант Е4 связан с увеличением общего холестерина и бета-липополипротеинов, снижением антиоксидантной клеточной активности, что является фактором риска сердечно-сосудистых заболеваний. Аллель Е4 рассматривается в качестве фактора риска болезни Альцгеймера. Механизм влияния мутации, возможно, следующий. ApoE необходим для доставки холестерина от производящих его глиальных клеток мозга (холестерин не может попасть из крови в мозг) до нейронов. Мутации ApoE нарушают этот процесс. Это также объясняет, почему при развитии этой болезни наблюдается разрушение синапсов, то есть связей между нервными клетками, и уменьшается количества холестерина в мозгу.
Генетическое исследование мутации ApoE
Описание
Генетическое исследование мутации ApoE — позволяет определить риск развития ишемической болезни сердца вследствие нарушения липидного обмена.
ApoE (аллельный полиморфизм гена aполипопротеина Е) — генетический маркёр риска нарушений липидного обмена. Синтезируется в печени и головном мозге.
Ген ApoE кодирует белок аполипопротеин E, участвующий в обмене липидов в крови (антиатеросклеротическое действие) и холестерина в мозге. Аполипопротеин E является компонентом хиломикронов и ЛПОНП плазмы крови, которые образуются в тонком кишечнике из всасываемых жиров и подвергаются эндоцитозу в печени, обеспечивает их рецепцию, а также обеспечивает перенос холестерина из глии в нейроны мозга.
Молекулярные эффекты мутации
При аллеле e2, уровень продукции ApoE снижен и нарушено его связывание с рецепторами в печени. В связи с этим, метаболизм хиломикронов и ЛПОНП замедлен и крови отмечается высокий уровень холестерина и триглицеридов и низкий уровень ЛПНП.
При аллеле e2 обычно наблюдается гиперлипопротеинемия 3 типа и резко возрастает риск атеросклероза при употреблении большого количества жира в пище. Также данный аллель обладает некоторой протективностью в отношении болезни Альцгеймера.
При аллеле e4 снижен уровень продукции ApoE, отмечаются высокие уровни холестерина, триглицеридов и ЛПНП в крови, а также происходит нарушение транспорта холестерина в мозге.
При аллеле e4 обычно присутствуют гиперхолестеринемия и атеросклероз сосудов, вследствие чего развивается ишемическая болезнь сердца, нарушена регенерация нейронов мозга и весьма высок риск болезни Альцгеймера, особенно на фоне приёма статинов.
Перед диагностикой не рекомендуется подвергать себя стрессовым ситуациям, принимать спиртные напитки и курить.
Рацион и приём лекарственных препаратов не влияет на результат исследования.
Интерпретация результатов
Для интерпретации результатов генетического тестирования требуется консультация врача-генетика.
Медицинские интернет-конференции
Языки
Изучение сочетания генотипов полиморфизмов APOE и APOJ у пациентов, страдающих болезнью Альцгеймера
Абросимова Ю.С., Барыльник Ю.Б., Бородулин В.Б., Бычков Е.Н., Паращенко А.Ф.
Резюме
Исследование полиморфизма в генах-кандидатах в последние годы является ведущим подходом при изучении роли генетической составляющей в патогенезе мультифакториальных заболеваний человека. На основании полученных результатов можно предположить, что наличие в генотипе аллеля T для изучаемого полиморфизма гена APOJ и присутствие аллели ε4 гена APOE обуславливает тенденцию к более ранним срокам начала БА.
Ключевые слова
Статья
Актуальность настоящего исследования определяется значительной распространенностью болезни Альцгеймера (БА). В большинстве экономически развитых стран на ее долю среди других причин деменции приходится от 50 до 70%. Исследование полиморфизма в генах-кандидатах в последние годы является ведущим подходом при изучении роли генетической составляющей в патогенезе мультифакториальных заболеваний человека [Lander E., Schork N.,1994].
Целью нашего исследования было сравнительное изучение частоты встречаемости заявленных аллелей у пациентов, страдающих БА.
Материалы и методы исследования. Проведено исследование образцов ДНК 70 пациентов ДАТ (59 женщин и 11 мужчин) в возрасте от 52 до 78 лет, находящихся на лечении в 20, 21 психиатрических отделениях 2 ГКБ им. В.И. Разумовского и ОКПБ Святой Софии. Диагностика БА проводилась на основании критериев МКБ-10 (1994), в соответствии с которыми определялись сенильный (рубрика F00.1) и пресенильный (рубрика F00.0) типы БА (СДАТ и ДАТ соответственно).
В настоящее время разработаны и внедрены в клиническую медицину фармакогенетические анализы, позволяющие считывать и обрабатывать большие объемы биологической информации. В работе использовалась методика, разработанная в Институте молекулярной биологии им. В.А.Энгельгарда РАН, основанная на гибридизации в микроячейках биологического чипа. Технология анализа генетического полиморфизма предполагает предварительную мультиплексную амплификацию фрагментов ДНК с использованием флуоресцентно меченых праймеров и добавление меченого продукта на биочип, где происходит его гибридизация с иммобилизированными в геле зондами. Ячейки с иммобилизованными зондами на планшете располагаются рядами, каждая ячейка содержит уникальный зонд. Возможность изучения полиморфизма генов на чипах в ходе исследования предоставлена ООО «Геночип», г. Саратов.
Результаты и обсуждение. В проведенных исследованиях обнаружены следующие распределения полиморфизма генов APOE и APOJ. Наиболее хорошо изучен ген аполипопротеина Е (АРОЕ). Активность белка АРОЕ у человека определяется носительством одного из трех аллелей гена АРОЕ: ε2 («дикий тип»), ε3 и ε4 [1, 4]. APOE (rs429358) с ДАТ – 70 % (полиморфизм был представлен по большей части гомозиготами по ε3/ε3 в 30% образцов, ε4/ε4 в 20% образцов, гетерозиготами ε3/ε4 составили 48%). Полиморфизм APOE (rs429358) пациентов с СДАТ был представлен по большей части гомозиготами по ε3/ε3 в 84% образцов, ε2/ε4 в 2% образцов, гетерозиготы ε2/ε3 составили 14%. Следует отметить, что гомозиготные варианты по ε4/ε4 отмечались только в группе пациентов с ДАТ и соответствовали пациенткам, у которых заболевание дебютировало раньше, чем у всех обследованных. Полученные данные согласуются с данными, что аллель ε2 обладает протективными свойствами и его наличие ассоциируется с пониженным риском БА и более поздним началом. В нашей работе гетерозиготы с ε2 встречались в очень небольшом количестве образцов, и все они соответствовали СДАТ.
Выявлен полиморфизм гена APOJ, маркера спорадических форм болезни Альцгеймера[1, 6]: APOJ (rs11136000) при ДАТ – 70% (C/C полиморфизм, т.е. «дикий» тип составил 45%, гетерозиготы C/T составили 25% и гомозиготы по рецессивному типу – T/T – были представлены 30% от всего количества исследованных образцов). APOJ (rs11136000) при СДАТ: обнаружено, что полиморфизм данного гена составляет 68% (C/C полиморфизм, т.е. «дикий» тип составил 48%, гетерозиготы C/T – 29% и гомозиготы T/T были представлены 23% от всего количества исследованных образцов). Продукт гена APOJ способствует, как полагают, защите нейронов при БА посредством удаления Aβ, предотвращения воспаления, подавления апоптоза нейронов и удаления погибших клеток [1, 2, 7]. В последнее время установлено, что полиморфизм гена APOJ (rs11136000) статистически значимо ассоциирован с риском развития БА [1, 3, 5]. Полиморфизмы C/T и T/T указывают на ослабление функции данного гена. Таким образом, в группе пациентов с ДАТ, около 20% пациентов, имеющих следующий вариант генотипа образца: ApoE (ε4/ ε4); ApoJ (T/T) может быть отнесена к группе риска по раннему началу заболевания и темпам ухудшения когнитивных функций в силу усиления процессов апоптоза и активации процессов воспаления.
Выводы. На основании полученных результатов можно предположить, что наличие в генотипе аллеля T для изучаемого полиморфизма гена APOJ и присутствие аллели ε4 гена APOE обуславливает тенденцию к более ранним срокам начала БА.