иных нозологических групп что это
Психиатрия
Студенту без шпаргалки никуда! Удобное и красивое оформление, ответы на все экзаменационные вопросы ведущих вузов России.
Оглавление
Приведённый ознакомительный фрагмент книги Психиатрия предоставлен нашим книжным партнёром — компанией ЛитРес.
5. Понятие нозологии
Синдром как этап заболевания может быть одинаковым при различных психических расстройствах, что обусловлено приспособлением организма к измененным условиям жизни (болезни) и достигается с помощью однотипных способов реагирования. Данное проявление наблюдается в виде симптомов и синдромов, которые при развитии болезни усложняются, трансформируясь из простых в сложные или из малых в большие. При различных психических заболеваниях клиниче-екая картина меняется в определенной последовательности, т. е. существует свойственный каждому заболеванию стереотип развития.
Выделяют общепатологический, свойственный всем болезням стереотип развития, и нозологический стереотип, который типичен для отдельных болезней.
Общепатологический стереотип развития заболеваний предполагает наличие общих закономерностей в их течении. На первоначальных этапах прогрессирующих психических заболеваний чаще обнаруживаются невротические расстройства, и лишь потом появляются аффективные, бредовые и психорганические, т. е. при прогрессировании психических заболеваний клиническая картина неуклонно усложняется и углубляется.
Например, формирование клинических проявлений у больных шизофренией таково: на начальных этапах обнаруживаются расстройства невротического уровня, астенические, фобические, затем появляются аффективные расстройства, бредовая симптоматика, усложняющаяся галлюцинациями и псевдогаллюцинациями, присоединяется синдром Кандинского-Клерамбо, сопровождающийся парафренным бредом и приводящий к апатическому слабоумию.
Следует отметить, что ни продуктивные, ни негативные расстройства не имеют абсолютной нозологической специфичности и лишь распространяются на род болезней или группы болезней — психогенные, эндогенные и экзогенно-органические.
В каждой из указанных групп болезней имеют место все выделенные продуктивные симптомы. Для примера: астенические и невротические синдромы характерны для неврозов и невротических развитий личности; аффективные, бредовые, галлюцинаторные, двигательные — для реактивных психозов, таких как депрессия, параноиды, ступорозные состояния, преходящие интеллектуальные расстройства — для истерических психозов.
Как при экзогенно-органических, так и при эндогенных заболеваниях имеются все вышеперечисленные синдромы. Также существует определенная предпочтительность, заключающаяся в наибольшей частоте и выраженности их для той или иной группы заболеваний. Несмотря на общепатологические закономерности формирования дефекта личности, негативные психические расстройства в связи с болезнью имеют неоднозначные тенденции в группах заболеваний.
Как правило, негативные расстройства представлены следующими синдромами: астеническим или цереброастеническим изменением личности, включающим психопатоподобные расстройства, при психогенных заболеваниях проявляющиеся в виде патохарактеро-логических расстройств.
Нозологические группы инвалидности
8 минут Ирина Смирнова 183
Инвалидность, если исходить из разнообразия нарушений физического или психического здоровья, понятие довольно объемное. Описать особенности людей с ограниченными возможностями, не используя специальной классификации, весьма сложно. Поэтому для организации помощи, адаптации и реабилитации (медицинской и социальной) принято разделять таких пациентов на определенные категории, называющиеся нозологические группы инвалидов (НГИ).
Понятие нозологической группы инвалидности
НГИ подразумевает под собой классификацию, согласно которой люди с ограниченными возможностями здоровья (ОВЗ) подразделяются на категории, характеризующие их отклонение. Понятие состоит из двух слов, то есть это производное от «нозология» или наука о болезнях (в переводе с древнегреческого νόσος «болезнь» + λόγος «учение, слово») и инвалид (от латинского in – «не» + validus – «сильный»).
Под термином инвалидность подразумевается состояние человека, характеризующееся физическими, психическими, интеллектуальными или сенсорными отклонениями, ведущими к нарушению либо ограничению его жизнедеятельности. Нозология, в свою очередь, полностью описывает заболевание – его отличие от здоровья, причины и механизмы возникновения, особенности типичных проявлений и поражения органов, а также выздоровления и смерти.
Из всего вышеописанного следует, что нозологическая группа инвалидов – это совокупность людей, имеющих схожие признаки патологии или родственные заболевания. Кроме того, при работе с такими пациентами обязательно следует учитывать и классификацию инвалидности по тяжести проявлений, что является важным при разработке терапевтических и социально-адаптивных мероприятий для них.
В медицинской практике людей с ОВЗ принято разделять на 2 основные группы и 3, отличающиеся по степени выраженности присутствующей симптоматики. Так, к первым двум относятся врожденная инвалидность, причиной которой стало аномальное развитие плода в утробе матери либо родовая травма, и приобретенная – возникшая после рождения на фоне повреждения или заболевания.
ВТЭК или врачебно-трудовая экспертная комиссия у взрослых выделяет 3 следующие группы:
Ограничения функциональности инвалидов принято разделять по категориям, связанным с отклонениями деятельности той или иной системы. К ним относятся нарушения:
Данное разделение инвалидов на различные группы является одним из самых емких и потому обширных. Благодаря ему, врач, увидев такую пометку в любом бланке, может получить приблизительную картину состояния пациента на текущий момент.
Нарушение зрения
Эта патология относится к сенсорным отклонениям, и является одной из основных разновидностей заболеваний, способных стать причиной получения группы инвалидности. По степени нарушения зрения выделяют несколько категорий пациентов:
Снижение качества зрения, в большинстве случаев сопровождается нарушением формирования пространственных образов, осуществления саморегуляции и самоконтроля, а также ухудшением точности движений тела и его координации. Кроме этого, отмечается изменение осанки, появление плоскостопия, и нередко слабость дыхательных мышц.
Сопутствующими патологиями при нарушении зрения, как правило, являются неврозы, болезни органов сердечно-сосудистой и дыхательной системы, и расстройства метаболических процессов. И также может наблюдаться снижение слуха, общее недоразвитие речевой функции, быстрая утомляемость, ДЦП (детский церебральный паралич) и иногда ММД (минимальная мозговая дисфункция).
Патологии слуха
Инвалиды со снижением качества слуха бывают: глухие (полная утрата слуховой функции) и слабослышащие. Глухие лишенные речи – это пациенты с врожденным отсутствием данного сенсора либо утратившие его в раннем детстве.
К глухим, но при этом имеющим речь в определенной степени, относятся пациенты, потерявшие слух в более позднем возрасте. Вследствие врожденной утраты слухового сенсора довольно часто развиваются патологические изменения функционирования вестибулярного аппарата, пространственной ориентации, ухудшается осанка. Кроме этого, формируется глухонемота и задержка в развитии способности к прямостоянию.
На фоне подобных нарушений, как вторичные патологии отмечаются психические отклонения – отставание функции мышления, проблемы с общением, скудность эмоций и плохая память. Слабослышащие, или люди с частичной утратой слуховой возможности, но при этом сохранившие речь, не испытывают трудностей, связанных со снижением умственных способностей.
Нарушение интеллекта
В основе признаков данной группы лежит недоразвитие различных аспектов психической функции: познавательных процессов, потребностно-мотивационной, эмоционально-волевой сферы и т. д. Ведущая роль в отклонениях психики отводится задержке развития познавательной способности, типичной характеристикой которой считается умственная отсталость.
Интеллектуальная отсталость – это неполноценное формирование психических процессов либо их задержка, что в основном проявляется снижением способностей, характерных для определенного периода созревания. К ним относятся социальные, когнитивные, речевые и моторные способности, которые в результате составляют базовый фундамент личности, и дают возможность для дальнейшего развития.
У человека с патологическими отклонениями умственного развития практически всегда наблюдается расстройство познавательной активности. Снижается скорость и интенсивность нервных процессов, качество высших психических функций, а также нарушается аналитико-синтетическая деятельность. На фоне данных отклонений нередко формируется дисплазия (патологическое изменение клеток).
Начинаются проблемы с костной тканью, осанкой, развивается деформация скелета, стоп, что, в общем, характеризуется как физическая дисгармоничность сопровождающаяся нарушением координации движений. Кроме этого, у таких пациентов отмечаются прочие сенсорные аномалии, заболевания внутренних органов, врожденные пороки сердца и эндокринные патологии.
У детей с умеренной формой умственной отсталости в 90–100% наблюдается моторная недостаточность, страдает темп, точность и согласованность движений. Они неуклюжи, медлительны, и имеют недостаточно сформированные механизмы бросков, бега и прыжков.
Изменения со стороны опорно-двигательного аппарата (ОДА)
Заболевания ОДА, способных привести к получению группы инвалидности, подразделяют на три вида:
У пациентов с группой инвалидности по нарушению функционирования ОДА ведущим является дефект данной системы – недоразвитие, патология либо потеря тех или иных двигательных способностей. При заболеваниях ОДА церебрального происхождения, происходит снижение опороспособности, нарушение равновесия, координации, ориентировки в пространстве, вертикальной позы, макро- и микромоторики.
Зачастую диагностируется остеохондроз, остеопороз, контрактуры, мышечная гипотрофия и дисгармоничность физического развития. Кроме этого, присоединяются заболевания дыхательной и сердечно-сосудистой системы, а также патологии внутренних органов. Нередко отмечается снижение качества зрения, слуха и интеллекта, что в результате ведет к низкой работоспособности.
При патологиях ОДА спинального происхождения диагностируется частичная либо абсолютная потеря чувствительности, движений, расстройство функционирования органов таза. Развиваются вегетативные дисфункции, образуются пролежни. Достаточно часто возникает остеопороз.
При поражении верхнего отдела (шейного) наблюдаются дыхательные и ортостатические нарушения. Развитие вялого паралича сопровождается мышечной атрофией, спастического – снижением подвижности суставов, появлением контрактур, повышением мышечного тонуса.
При патологиях ОДА в результате врожденных пороков либо ампутации утрачивается нормальная опороспособность и ходьба (при потере ног), осанка, координация движений, а также способность поддержания вертикальной позы. Зачастую при таких изменениях отмечается уменьшение сосудистого русла и массы тела.
В целом данные патологии сопровождаются дегенеративными изменениями костной и нервно-мышечной ткани, расстройством регуляторных механизмов, контрактур. Возникают дисфункции дыхания, кровообращения, пищеварения обменных процессов, в результате чего снижается работоспособность. Кроме всего вышеперечисленного, нередко присутствуют фантомные боли, доставляющие значительный дискомфорт пациентам.
Одним из видов поражения ОДА, ведущих к инвалидности являются насильственные движения или непроизвольные двигательные реакции (к примеру, тремор верхних конечностей). Они создают большие помехи для выполнения произвольных движений, и затрудняют овладение многими навыками двигательного аппарата.
Иных нозологических групп что это
На сегодняшний день Аральская проблема, как крупнейшая экологическая катастрофа планеты, приобрела острейший характер. Интенсивное опустынивание и устойчивые необратимые процессы деградации окружающей природной среды, ухудшение условий жизни, рост заболеваемости вызвали новые социально-экономические и экологические ситуации, требующие законодательного решения и правового регулирования мер социальной защиты населения, проживающего в экологически неблагоприятных районах.
Экологическое загрязнение оказывает отрицательное влияние на заболеваемость населения, действие экологических факторов проявляется увеличением нарушений со стороны центральной нервной системы. В связи с этим люди, проживающие в экологически неблагоприятной среде, имеют сниженные показатели здоровья и функционального состояния [1, 2, 3].
Продолжительное воздействие экстремальных факторов способствует развитию синдрома дезадаптации, являющегося нередко причиной патологических сдвигов в нервной, сердечно-сосудистой системах, главным образом в виде синдрома вегетативной дистонии [4].
Влияние вредных факторов окружающей среды на здоровье людей создает множество условий, определяющих формирование компенсаторных процессов, переходящих в срыв адаптации. Основные показатели общественного здоровья связаны не только с факторами окружающей среды, но и социально-гигиеническими особенностями [5].
Таким образом, экологическая ситуация в регионе Приаралья по-прежнему остается крайне тревожной, и при разработке политики планов экономического развития регионов по-прежнему недостаточное внимание уделяется вопросам влияния окружающей среды на здоровье людей, проживающих в регионе. Все вышеизложенное определила актуальность проблемы и послужило теоретической основой для проведения клинико-неврологического исследования.
Цель: привести сравнительный анализ нозологических форм заболеваний нервной системы населения г. Шалкар Актюбинской области и п. Атасу Карагандинской области.
Материалы и методы исследования
По закону Республики Казахстан от 30 июня 1992 года № 1468-ХII «О социальной защите граждан, пострадавших вследствие экологического бедствия в Приаралье» территория экологического бедствия в Приаралье г. Шалкар Актюбинской области входит в зону экологической катастрофы, и п.Атасу Карагандинской области является зоной сравнения. В рамках реализации НТП «Комплексные подходы в управлении состоянием здоровья населения Приаралья» были проведены исследования населения г.Шалкар. При проведении клинического исследования применялось электрофизиологическое оборудование, включающее автоматизированный комплекс «Варикард», фирмы «Рамена», 2012 г. Диагноз установлен на основании жалобы больных, анамнеза заболевания, результатов клинико-неврологических осмотров, электрофизиологических исследований из амбулаторных карт.
Эпидемиологическая значимость выбранных для исследования заболеваний нервной системы по МКБ-10 оценивалась по интенсивным показателям частоты заболеваний, так же привели к стандартизации интенсивных показателей обследованных на 1000 населения. Полученные результаты были статистически обработаны по программе электронных таблиц EXCEL в системе WINDOWS.
Результаты исследования и их обсуждения
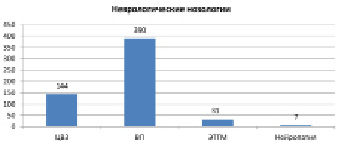
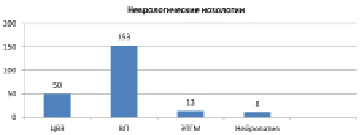
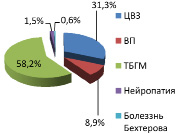
Приведен сравнительный анализ состояния нервной системы обследованных в г. Шалкар и п. Атасу. В г. Шалкар частота возникновения заболевания цереброваскулярные заболевания (ЦВЗ) составила 144,1 (25 %) случая, вертеброгенные патологии 391 (68 %), травматическая болезнь головного мозга (ТБГМ) 32 (6 %) случая, нейропатия 8 (1,4 %) случаев на 1000 обследованного населения. В п.Атасу составила ЦВЗ 64 (22,3 %) случая, вертеброгенных патологии 196 (68,7 %) случая, ТБГМ 17(6 %) случаев, нейропатия 10,2 (3,4 %) случаев на 1000 обследованного населения. При сравнении результатов клинико-неврологического исследования г. Шалкар и п. Атасу выявилось, что по встречаемости заболевания вертеброгенных патологии в 2 раза больше в г. Шалкар, чем в п. Атасу (рис. 1, 2).
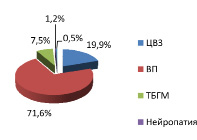
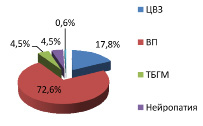
В структуре неврологических нозологий среди мужчин распространенность вертеброгенных патологии в г. Шалкар была больше в 3,7 раза, чем п. Атасу. Также выявилось у мужчин г. Шалкар превышение по ЦВЗ в 1,9 раза, по ТБГМ в 2,5 раза, чем среди мужчин п. Атасу. По нейропатиям среди мужчин г. Шалкар и п. Атасу в одинаковом количестве (рис. 2, 4).
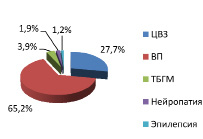
В то же время у женщин г. Шалкар оказалось вертеброгенные патологии и ТБГМ в 1,4 раза больше, чем у женщин п. Атасу. А по нейропатиям среди женщин п. Атасу оказалось в 1,4 раза больше, чем у женщин г. Шалкар. В г. Шалкар выявлен единичный случай болезнь Бехтерева среди мужчин, а в п. Атасу выявлен единичный случай миастении генерализованной формы среди женщин (рис. 3, 4, 5, 6).
Рис. 1. Распространенность заболеваний нервной системы в г. Шалкар по нозологическим формам
Рис. 2. Распространенность заболеваний нервной системы в г. Атасу по нозологическим формам
Рис. 3. Структура неврологических нозологий среди мужчин г. Шалкар
Рис. 4. Структура неврологических нозологий среди женщин г. Шалкар
Рис. 5. Структура неврологических нозологий среди мужчин п. Атасу
Рис. 6. Структура неврологических нозологий среди женщин п. Атасу
1. Результаты клинико-неврологических исследований показали высокую распространенность вертеброгенных патологий и ЦВЗ в г. Шалкар. ЦВЗ были: астено-невротический, а-депрессивный, а-вегетативный и судорожный синдромы.
2. При сравнении половых различий отмечено, что наибольшее количество здоровых женщин встречалось в п. Атасу.
3. В структуре заболеваний нервной системы среди мужчин и женщин г. Шалкар на первом месте были заболевания вертеброгенные патологии, на втором ЦВЗ, на третьем месте ТБГМ, на четвертом нейропатии. Выявлены единичные случаи болезни Бехтерева, и эпилепсии в г. Шалкар, а в п. Атасу среди женщин выявлено миастения генерализованной формы.
Иных нозологических групп что это
Научно-клиническое отделение гематологической хирургии Гематологического научного центра Минздрава РФ, Москва
Пересмотренная Классификация ВОЗ опухолей гемопоэтической и лимфоидной ткани, 2017 (4-е издание): миелоидные неоплазии
Журнал: Архив патологии. 2018;80(6): 43-49
Ковригина А. М. Пересмотренная Классификация ВОЗ опухолей гемопоэтической и лимфоидной ткани, 2017 (4-е издание): миелоидные неоплазии. Архив патологии. 2018;80(6):43-49.
Kovrigina A M. A revised 4 edition WHO Classification of Tumors of Hematopoietic and Lymphoid Tissues, 2017: myeloid neoplasms. Arkhiv Patologii. 2018;80(6):43-49.
https://doi.org/10.17116/patol20188006143
Научно-клиническое отделение гематологической хирургии Гематологического научного центра Минздрава РФ, Москва
Представлены новые молекулярные данные, принципы классификации и критерии диагностики миелоидных неоплазий согласно новой редакции Классификации ВОЗ опухолей гемопоэтической и лимфоидной ткани (2017). Изложены современные представления о клональном гемопоэзе и модели клональной эволюции, позволяющие охарактеризовать общие черты молекулярного патогенеза миелоидных неоплазий. Рассматриваются новые сведения и общие принципы диагностики миелоидных неоплазий: Ph-негативных миелопролиферативных заболеваний, миелодиспластических синдромов, миелоидных/лимфоидных опухолей с эозинофилией и реаранжировками PDGFRA, PDGFRB, FGFR1, PCM1-JAK2, заболеваний из группы миелодиспластических/миелопролиферативных заболеваний. Обращается внимание на возможности и ограничения патоморфологической дифференциальной диагностики при исследовании трепанобиоптатов костного мозга в условиях повседневной работы врача-патологоанатома.
Научно-клиническое отделение гематологической хирургии Гематологического научного центра Минздрава РФ, Москва
В октябре 2017 г. вышла из печати новая редакция 4-го издания Классификации ВОЗ (2017) опухолей гемопоэтической и лимфоидной ткани [1]. После выхода 4-го издания классификации (2008) за последние годы в научной литературе накоплены новые данные о молекулярном патогенезе клональных миелоидных неоплазий, что позволило разработать новые подходы к диагностике, прогнозу заболевания и лечению с использованием так называемой таргетной терапии. Как и предыдущие издания, новая редакция Классификации ВОЗ базируется на комплексе анамнестических, клинических, лабораторных, цитоморфологических, цитохимических, гистологических, иммунофенотипических, цитогенетических и молекулярно-генетических характеристик для установления той или иной нозологической формы. Диагностическая значимость гистологического метода исследования трепанобиоптата костного мозга для разных нозологий различна. В новой редакции 4-го издания ВОЗ (2017) произошли значительные изменения в разделе патоморфологической диагностики Ph-негативных миелопролиферативных заболеваний (Ph-МПЗ) с учетом высокого уровня воспроизводимости разработанных критериев (76—88%) [2, 3]. Гистологическое исследование трепанобиоптата костного мозга введено в большие критерии диагностики для каждой нозологии в рамках группы Ph-МПЗ. Объем диагностического материала трепанобиоптата костного мозга крайне важен для проведения дифференциальной диагностики. Так, во введении к разделу «Миелоидные неоплазии» в новой редакции ВОЗ [1] регламентируется длина диагностического фрагмента губчатой костной ткани не менее 1,5 см, рекомендуется исследование не менее 10 сохранных костномозговых полостей. При исследовании трепанобиоптата костного мозга необходимо охарактеризовать клеточность кроветворной ткани (относительно возрастной нормы), возможное наличие неравномерности ее распределения («patch»), гистотопографии ростков миелопоза, сохранность или нарушение дифференцировки/созревания клеточных элементов 3 ростков миелопоэза, наличие изменений стромы (отек, серозная атрофия, ретикулиновый, коллагеновый фиброз), остеосклероз костных балок, наличие/отсутствие лимфоидной инфильтрации и ее характер, признаки гемосидероза.
Для миелодиспластических синдромов (МДС) патоморфологическое исследование костного мозга является одним из звеньев комплексной диагностики, основанной прежде всего на исключении иной этиологии цитопений. Необходимым условием для постановки диагноза МДС, как и острых лейкозов, является цитологическое исследование мазков крови (подсчет 200 клеток) и аспирата костного мозга (подсчет 500 клеток).
Пересмотренная Классификация ВОЗ опухолей кроветворной и лимфоидной ткани (2017) представлена в табл. 1.

1. Миелопролиферативные заболевания
Учитывая лингвистические особенности и традиции русскоязычного перевода, многолетнюю сложившуюся гематологическую и гематопатологическую практику с традиционным использованием термина «хронические миелопролиферативные заболевания», представляется целесообразным использовать в русскоязычной литературе для данной группы заболеваний термин «миелопролиферативные заболевания» вместо «миелопролиферативные неоплазии/опухоли».
Изменения последовательности ДНК, называемые драйверными мутациями (driver mutations), придают пролиферативные преимущества клеточной популяции, что имеет онкогенный потенциал. Некоторые драйверные мутации наследуются в зародышевой линии, но большинство возникает в соматических клетках в течение жизни, вместе со многими мутациями-«пассажирами» (passenger mutations), не определяющими развитие опухоли/неоплазии. К драйверным диагностическим мутациям при Ph-МПЗ относятся мутации JAK2, MPL, Calreticulin (CALR), что биологически определяет эту группу миелоидных неоплазий в сочетании с цитозами, морфологическими особенностями в трепанобиоптатах костного мозга, другими клиническими признаками (плетора, наличие артериальных и венозных тромбозов, спленомегалия и анемия при первичном миелофиброзе). В настоящее время существуют трипл-негативные случаи эссенциальной тромбоцитемии, первичного миелофиброза, прогноз этих заболеваний при трипл-негативном статусе уточняется. Соматические мутации ASXL1, TET2, EZH2, IDH½, SRSF2, SF3B1 имеют прогностическое значение и используются для верификации клональности МПЗ при трипл-негативных случаях Ph-МПЗ.
Для истинной полицитемии введены новые референсные значения Hb, Ht, позволяющие избежать гиподиагностики истинной полицитемии. Определение степени ретикулинового фиброза имеет важное прогностическое значение, что обосновывает выполнение трепанобиопсии костного мозга даже в случаях развернутой клинической и гематологической картины истинной полицитемии. Ниже приведены критерии для диагностики истинной полицитемии [1].
1. Hb более 16,5 г/мл для мужчин, Hb более 16,0 г/мл для женщин, или Ht более 0,49% для мужчин, Ht более 0,48% для женщин, или увеличение массы циркулирующих эритроцитов (RCM) более чем на 25% выше референсного значения.
2. Гистологическое исследование костного мозга с гиперплазией всех ростков миелопоэза, пролиферация полимфорных различных по размеру мегакариоцитов со зрелой морфологией.
Субнормальный уровень EPO.
Для установления диагноза истинной полицитемии необходимо наличие 3 больших критериев, или первые 2 большие и 1 малый критерий.
При уровне Hb более 18,5 г/л, Ht 55,5% у мужчин и Hb более 16,5 г/л, Ht более 49,5% у женщин допускается отказ от трепанобиопсии костного мозга. Вместе с тем оценка ретикулинового фиброза стромы при гистологическом исследовании трепанобиоптата костного мозга имеет прогностическое значение — повышенный риск трансформации в постполицитемический миелофиброз (около 20% пациентов).
Критерии диагностики эссенциальной тромбоцитемии [1] включают:
1. Количество тромбоцитов 450·10 9 /л и более.
2. При гистологическом исследовании костного мозга — пролиферация крупных мегакариоцитов со зрелой морфологией с гиперлобулярными ядрами без выраженного увеличения или омоложения гранулоцитарного и эритроидного ростков миелопоэза.
3. Отсутствие критериев для BCR-ABL1+ ХМЛ, истинной полицитемии, первичного миелофиброза или других миелоидных опухолей.
4. Мутации JAK2, CALR или MPL.
Наличие клонального маркера или исключение реактивного тромбоцитоза.
Диагноз эссенциальной тромбоцитемии требует наличия всех больших критериев или первых 3 больших критериев и 1 малого критерия.
В пересмотренной Классификации ВОЗ (2017) [1] подчеркивается важность дифференциальной диагностики эссенциальной тромбоцитемии и префиброзной/ранней стадии первичного миелофиброза с обязательной характеристикой степени ретикулинового фиброза по Европейской системе градации (табл. 2).

В пересмотренной Классификации ВОЗ (2017) для первичного миелофиброза введены 2 стадии: префиброзная/ранняя и фиброзная (развернутая) с соответствующими большими и малыми критериями. При наличии степени ретикулинового фиброза MF >1 рекомендуется проводить гистохимическую окраску по Массону и оценку коллагенового фиброза (табл. 3).

В табл. 4 сопоставлены

Нозологическая форма «Миелопролиферативное заболевание, неклассифицируемое» устанавливается при наличии несомненных клинических и лабораторных признаков МПЗ и отсутствии критериев, удовлетворяющих какой-либо специфической нозологии из группы Ph-МПЗ. Данная нозологическая форма в большинстве случаев используется при первичной диагностике ранних стадий Ph-МПЗ или диагностике на стадии миелофиброза/остеосклероза, или на стадии трансформации МПЗ в более агрессивную стадию с увеличенным количеством бластов (в гемограмме/миелограмме) при отсутствии анамнестических данных о наличии МПЗ и предыдущих исследований трепанобиоптатов костного мозга. При этом обязательным является исключение BCR—ABL1+ ХМЛ и заболевания из группы миелоидных/лимфоидных опухолей с реаранжировками PDGFRA, PDGFRB, FGFR1, PCM1-JAK2 при проведении молекулярных исследований.
2. Мастоцитозы
В новой редакции ВОЗ (2017) группа мастоцитозов выведена из группы МПЗ в связи с их агрессивным клиническим течением. Гистогенез из общей костномозговой миелоидной клетки-предшественницы с дальнейшей миграцией и дифференцировкой в органах и тканях (кожа, слизистые оболочки дыхательных путей, желудочно-кишечного тракта) отличает мастоциты (тучные клетки) от клеток гранулоцитарного ряда с базофильной дифференцировкой. В части случаев пролиферация мастоцитов сопровождает другие гематологические заболевания. Морфологические признаки мастоцитозов чрезвычайно разнообразны. При окраске по Гимзе/азуром не всегда видны цитоплазматические базофильные гранулы, атипия мастоцитов может имитировать другие опухоли и предполагает расширение ИГХ-исследования для верификации диагноза.
Среди мастоцитозов выделяют:
— системный мастоцитоз, ассоциированный с другими гематологическими заболеваниями (миелодиспластические синдромы, хронический миеломоноцитарный лейкоз, миелопролиферативные заболевания), острые миелоидные лейкозы,
3. Миелоидные/лимфоидные опухоли с эозинофилией и реаранжировками генов
Эта группа заболеваний протекает с гиперэозинофилией (более 1,5·10 9 /л), требует исключения реактивных эозинофилий. Морфологическая картина в трепанобиоптатах костного мозга чрезвычайно полиморфна и может носить черты хронического эозинофильного лейкоза, неуточненного (NOS), МПЗ с выраженной эозинофильной дифференцировкой и преобладанием клеток промежуточного пула с псевдопельгероидными формами, в части случаев в дебюте может быть диагностирован острый лимфобластный лейкоз (В- или Т-клеточный).
В данную группу включены:
— миелоидная/лимфоидная опухоль с реаранжировкой PDGFRA,
— миелоидная/лимфоидная опухоль с реаранжировкой PDGFRB,
— миелоидная/лимфоидная опухоль с реаранжировкой FGFR1,
— миелоидная/лимфоидная опухоль с реаранжировкой PCM1-JAK2.
Выявление соответствующих реаранжировок генов является определяющим критерием для нозологических форм данной группы.
4. Миелодиспластические синдромы
МДС — группа клональных миелоидных заболеваний, характеризующихся цитопенией, неэффективным гемопоэзом, морфологическими признаками дисплазии, возможностью трансформации в острый миелоидный лейкоз. МДС — это наиболее частое гематологическое заболевание миелоидной природы [6, 7]. В новой редакции ВОЗ (2017) в разделе МДС термин «рефрактерная анемия/цитопения» заменен на «миелодиспластический синдром», тем самым подчеркивается важность морфологических признаков дисплазии миелопоэза и количества бластных клеток, а не самого факта цитопении, что является неотъемлемым лабораторным признаком МДС, но не всегда коррелирующим с дисплазией соответствующей клеточной линии дифференцировки миелопоэза.
Новые молекулярные технологии NGS (next generation sequence), основанные на массивном параллельном секвенировании однонитевых библиотек фрагментированной ДНК образцов ткани/крови, позволили приблизиться к пониманию молекулярных основ патогенеза миелоидных неоплазий как модели клональной эволюции: клональный гемопоэз неопределенного потенциала (CHIP) — цитопении, ассоциированные с клональными мутациями (CCUS), МДС — острый миелоидный лейкоз. Накопление неблагоприятных соматических мутаций при МПЗ определяет риск трансформации в МДС или вторичный острый миелоидный лейкоз. Схематично этапы клональной эволюции можно изложить следующим образом: стволовая кроветворная клетка с CD90+, CD34+, CD38–, CD45RA– может приобретать соматические мутации генов, участвующих в эпигенетической регуляции TET2, DNMT3A, далее происходит клональная экспансия коммитированных клеток-предшественниц с высоким пролиферативным потенциалом и приобретением дополнительных мутаций, что приводит к вытестению нормального пула коммитированных клеток и формированию субстрата МДС с приобретением соответствующих клинических и лабораторных признаков. Клональный гемопоэз неопределенного потенциала (CHIP) детерминирован 2% мутантной аллельной фракцией и отсутствием у пациента признаков гематологического заболевания/цитопении, для CHIP наиболее характерны мутации DNMT3A, TET2, SF3B1. Расчетный риск развития гематологического заболевания при CHIP составляет 0,5—1% в год и сопоставим с моноклональным В-клеточным лимфоцитозом (MBL), моноклональной гаммапатией неопределенного значения (MGUS). Установлено, что до 35% пациентов с идиопатической цитопенией неопределенного значения (ICUS) имеют соматические мутации генов без морфологических или цитогенетических признаков МДС [8]. CHIP может быть выявлен у 10% пациентов в возрасте старше 65 лет и у 20% в возрасте старше 90 лет [9—11]. Интересно, что при апластической анемии в части случаев обнаружены мутации, характерные для CHIP, такие как DNMT3A, ASXL1 [12]. Вместе с тем известно, что эти мутации обладают неблагоприятным прогнозом при МДС, МПЗ.
Принцип клональной эволюции является базовой позицией для новой редакции Классификации ВОЗ (2017). Введение в Классификацию новых молекулярно-генетических данных о соматических мутациях при миелоидных неоплазиях и острых лейкозах имеет целью создание новых прогностических индексов, использование таргетных ингибиторов мутированных генов (гипометилирующие препараты, анти-IDH½— и анти-EZH2-ингибиторы и другие «малые молекулы» таргетной терапии). Необходимо отметить, что мутации TET2, DNMT3A, участвующие в метилировании ДНК, возникающие на ранних этапах коммитированной кроветворной клетки и характерные для CHIP, могут встречаться при лимфомах, а mutSF3B1 — при В-ХЛЛ, что свидетельствует о наличии общей коммитированной кроветворной клетки-предшественницы с потенциалом мультилинейной дифференцировки [13, 14].
В настоящее время выделяют следующие основные группы генов, участвующие и определяющие патогенез миелоидных опухолей:
2) гены, участвующие в сплайсинге РНК: SF3B1, SRSF2, U2AF1, ZRSR2, LUC7L2, U2AF2, PRPF8, SF1;
3) миелоидные транскрипционные факторы: RUNX1, CUX1, ETV6, NPM1, ATA2, WT1, CEBPA;
4) гены — опухолевые супрессоры: TP53, PHF6;
5) гены, участвующие в сигнальных путях: JAK2, NF1, NRAS, CBL, MPL, KRAS, FLT3, GNAS, KIT, PTPN11, GNB1, другие — BRCC3, ATM, FANCL, PIGA (при пароксизмальной ночной гемоглобинурии);
6) гены мультибелкового когезиного комплекса, управляющие трехмерной структурой хроматина, имеющие ключевое значение в репарации ДНК, в когезии и сегрегации хромосом во время клеточного деления (митоза/мейоза): STAG2, RAD221, SMC1, SMC2.
В патогенезе МДС участвует более 50 генов, среди них 6 генов встречаются наиболее часто (табл. 5).

Завершая раздел новых молекулярно-генетических данных, следует резюмировать:
1. Соматические мутации в отличие от молекулярных маркеров при Ph+ МПЗ и Ph-МПЗ не имеют специфичности, на сегодняшний день их диагностическая значимость для МДС не определена, за исключением мутации SF3B1, наличие которой при МДС позволяет установить диагноз МДС с кольцевыми сидеробластами и унилинейной или мультилинейной дисплазией даже при наличии кольцевидных сидеробластов 5% и более. Выявлены устойчивые соматические мутации 6/40 генов примерно в 10% МДС, а до 90% случаев МДС имеют одну или несколько соматических мутаций.
2. Соматические мутации генов TET2, DNMT3a, ANSXL1, участвующих в эпигенетической регуляции, при МДС определяются на уровне популяционной частоты и неспецифичны (встречаются при миелоидных и лимфоидных опухолях).
3. Для диагностики МДС более чувствительны соматические мутации генов, участвующих в сплайсинге РНК, –SRSF2, U2AF1, SF3B1; транскрипционной регуляции – RUNX1, репарации ДНК — P53.
4. При наличии ICUS важны мутантная аллельная частота (VAF 30—40%), группа и количество (2 и более) мутированных генов, возраст пациента.
Переходя к комплексной диагностике, следует еще раз подчеркнуть, что наличие, длительность цитопений, исключение других причин цитопений, цитологическое исследование костного мозга/крови, цитогенетическое исследование являются базовыми для диагностики МДС. Вместе с тем наличие генетических аномалий +8, –Y, или del (20q) не является определяющим для диагноза МДС без морфологических признаков дисплазии. В настоящее время иммуногистохимическое исследование трепанобиоптатов костного мозга с полуколичественным определением CD34+ клеток-предшественниц, метод проточной цитометрии для выявления аберрантного иммунофенотипа клеток гранулоцитарного и эритроидного ростков являются дополнительными методами, а молекулярно-генетические исследования (выявление соматических мутаций генов путем таргетного секвенирования) не имеют диагностического значения (за исключением mut SF3B1) и используются как факторы прогноза и доказательства клональности гемопоэза.
При гистологическом исследовании трепанобиоптата костного мозга для субстрата МДС в патоморфологическом описании необходимо указать на наналичие/отсутствие фиброза стромы, лимфоидных очажков, определить клеточность кроветворной ткани (относительно возрастной нормы), что необходимо для выделения гипопластического варианта МДС, при котором эффективна иммуносупрессивная терапия. Гистологически оцениваются признаки дисплазии 2 ростков миелопоэза: мегакариоцитарного (монобилобулярные формы, клетки с фрагментированными ядрами, микроформы), эритроидного ростка («блок» дифференцировки эритроидного ростка, морфологические признаки апоптоза эритрокариоцитов, атипичные митозы). Признаки дисгранулоцитопоэза оцениваются, как правило, при цитологическом исследовании.
Нововведением пересмотренной Классификации в разделе МДС является пересчет количества бластов на все ядросодержашие клетки костного мозга в случае резкого расширения эритроидного ростка (50% и более всех ядросодержащих клеток костного мозга), в связи с чем подтип острого эритроидного лейкоза эритромиелоз (ВОЗ, 2008) практически полностью перешел в раздел МДС с избытком бластов.
5. Миелодиспластические/миелопролиферативные заболевания (МДС/МПЗ)
Данная группа характеризуется сочетанием клинических признаков — пении и цитоза и признаков дисплазии и атипии при патоморфологическом исследовании, при отсутствии критериев и молекулярных данных, удовлетворяющих другим нозологиям МДС, BCR—ABL1+ ХМЛ и Ph-МПЗ.
К группе МДС/МПЗ относятся:
1. Хронический миеломоноцитарный лейкоз (ХММЛ). Случаи трансформации МДС или Ph-МПЗ по типу ХММЛ исключены из данной нозологии. Необходимо исключение лейкемоидной реакции, реактивных моноцитозов (инфекционные, аутоиммунные заболевания, паранеопластические реакции), BCR—ABL1-позитивного ХМЛ с моноцитозом (химерный транскрипт p190), Ph-МПЗ c моноцитозом, МДС с моноцитозом. Выделяют диспластический тип ХММЛ (лейкоциты до 13·10 9 /л) с преобладающими признаками дисплазии и пролиферативный тип ХММЛ с лейкоцитозом более 13·10 9 /л, гиперклеточным костным мозгом с расширением гранулоцитарного ростка, признаками дисплазии и атипии мегакариоцитарного ростка. При диспластической фазе допустимо отсутствие абсолютного моноцитоза (моноциты более 1·10 9 /л). Соответственно подсчету бластов в гемограмме/миелограмме в пересмотренной редакции ВОЗ (2017) [1] выделяют ХММЛ-0 (менее 2% бластов в крови, менее 5% в костном мозге), ХММЛ-1 (2—4% бластов в крови, 5—9% бластов в костном мозге), ХММЛ-2 (5—19% бластов в крови, 10—19% бластов в костном мозге). Обязательным условием является наличие устойчивого (в динамике) относительного моноцитоза 10% и более. При ХММЛ могут встречаться лимфаденопатия, гепатоспленомегалия, вовлечение других органов с морфологией экстрамедуллярного миелопоза.
2. Атипичный хронический миелоидный лейкоз, BCR—ABL1-негативный. Морфологическая картина, как правило, требует проведения дифференциальной диагностики с BCR—ABL1+ ХМЛ, лейкемоидной реакцией. Молекулярные исследования в данных случаях необходимы и является определяющими для исключения или установления диагноза BCR—ABL1+ ХМЛ. Для атипичного хронического миелоидного лейкоза характерны соматические мутации SETBP1 и/или ETNK1.
3. Ювенильный миеломоноцитарный лейкоз. Чаще встречается у лиц мужского пола, возрастной диапазон 9—14 лет, 75% случаев диагностируется в возрасте до 3 лет. Среди генетических аномалий, характерных и преобладающих для данной нозологии, отмечаются мутация NF1 и ассоциация с нейрофиброматозом 1-го типа, соматические мутации PTPN11, KRAS, NRAS или герминальная мутация CBL. Обязательными условиями для диагноза являются: абсолютный моноцитоз более 1·10 9 /л, исключение BCR—ABL1+ ХМЛ. Костный мозг характеризуется пролиферацией клеток гранулоцитарной и моноцитарной линий дифференцировки гранулоцитопоэза.
4. МДС/МПЗ с кольцевыми сидеробластами и тромбоцитозом. Эта нозология обрела самостоятельное значение по сравнению с Классификацией 2008 г. (предполагаемая нозологическая форма в 2008 г., 4-е изд.) благодаря устойчивым клиническо-лабораторным и молекулярным признакам: анемия, 15% и более кольцевых сидеробластов, тромбоцитоз 450‧10 9 /л и более, частое сочетание мутаций SF3B1 и драйверных мутаций JAK2, Calreticulin, MPL, характерных для Ph-МПЗ. Условием диагноза является цитогенетическое/FISH-исследование для исключения миелодиспластического синдрома, ассоциированного с del (5q), протекающего с тромбоцитозом. Морфологически характерными являются гиперклеточный костный мозг за счет расширения эритроидного ростка с нерезко выраженными признаками дизэритропоэза, пролиферация мегакариоцитов с преобладанием признаков атипии.
5. МДС/МПЗ, неклассифицируемые.
Это сложная группа заболеваний, требующая осторожного и взвешенного применения, чтобы не превратить данную нозологию в «корзину» случаев с недостаточными для диагностики лабораторными и молекулярными данными при отсутствии анамнестических данных. Эта нозологическая форма используется при отсутствии в анамнезе у пациента признаков МПЗ (с трансформацией по типу МДС в процессе клональной эволюции), исключение других заболеваний из группы МДС/МПЗ, МПЗ и МДС (в том числе с del (5q)), исключение мутаций PDGFRA, PDGFRB, FGFR1, PCM1-JAK2.
Таким образом, новая редакция Классификации ВОЗ (2017) опухолей гемопоэтической и лимфоидной ткани в разделе «Миелоидные неоплазии» предполагает комплексную диагностику той или иной нозологической формы, включает новейшие данные по молекулярному патогенезу миелоидных заболеваний. В своей работе врачу-патологоанатому в связи с невозможностью использовать на практике данные таргетного секвенирования необходимо тесно взаимодействовать с клиницистами-гематологами, онкологами для анализа всей полноты анамнестических, клинико-лабораторных данных, при этом важна крайняя взвешенность патоморфологических описаний и заключений по материалу трепанобиоптатов костного мозга, биоптатов органов/тканей. При отсутствии достаточной клинической информации, или невозможности проведения гистохимических, иммуногистохимических исследований, или отсутствии опыта в патоморфологической диагностике гематологических/онкогематологических заболеваний целесообразно сделать лишь описание морфологической картины с рекомендацией дообследования пациента и повторным обследованием в динамике, уточнением характера процесса и нозологической формы в соответствующем специализированном медицинском учреждении.
Автор заявляет об отсутствии конфликта интересов.